2024 年 6 月 27 日,中国国家医药产品监督管理局药品审评中心发布了令人振奋的消息:一种干细胞新药——艾米迈托赛注射液(人脐带间充质干细胞)被列入优先批准品种名单。
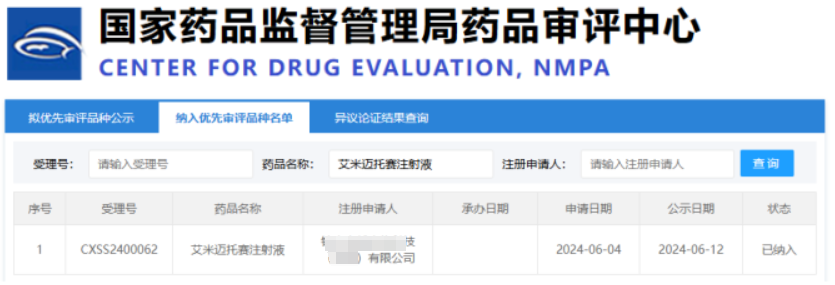
据悉,这是国内首个申请上市的干细胞新药,临床适应症为激素衰竭的急性移植物抗宿主病(aGVHD)。
移植物抗宿主病(GVHD)是一种在骨髓移植(BMT)后引起多系统损伤的系统性疾病,是导致死亡的重要原因之一,分为急性(aG)和慢性(cG)。前者发生在 BMT 后 3 个月内,后者发生在 BMT 后 3 个月中。免疫功能低下的个体在接受不同 HLA 水平的血液时也可能出现 GVHD,这可能是致命的。移植物抗宿主病是一种免疫反应异常的系统性疾病,临床表现复杂。受影响的主要器官是皮肤、消化道和肝脏。局部使用可的松软膏对皮肤损伤有效,全身治疗包括营养支持、泼尼松、环磷酰胺、抗淋巴细胞球蛋白、环孢菌素、硫唑嘌呤等。食道扩张和抗反流治疗可以有效缓解症状,但扩张过程中有穿孔的风险。
间充质干细胞具有再生、抗炎和免疫调节特性,这是通过调节先天和适应性免疫反应,抑制T、B 淋巴细胞和 NK 细胞的增殖和功能,以及树突状细胞的成熟,并诱导调节性 T 细胞的产生来实现的;其中一些作用是由可溶性因子如转化生长因子 β(TGF-β)和前列腺素 E2 介导的。由于其免疫抑制特性,间充质干细胞被认为是移植物抗宿主病(GVHD)和预防移植排斥反应的潜在候选者。
01 什么是优先审批?
优先审评审批流程是指符合一定条件的药品申请优先进入药品审评中心的审评审批流程,以加快其上市进程。该方案适用于临床急需的罕见病药物和儿科药物等特殊类型的药物。这些药物之所以能够申请优先审评审批程序,是因为它们具有明显的临床优势,可以显著提高医疗保障水平,提高患者的治疗效果和生活质量。
02 如何才能被纳入优先审批品种名单?
要被纳入优先审批品种名单,药物需要满足以下严格条件:
临床急需:对于现有治疗方法无效或没有有效治疗方法的严重疾病,可以显著改善患者的健康状况。
强有力的创新:药物在治疗机制、疗效和安全性方面有重大创新,可以填补现有的医疗空白。
充分的临床试验证据:该药物在临床试验阶段表现出明确的疗效和可接受的安全性,具有充分的科学依据。
艾米迈托赛注射液通过利用人脐带间充质干细胞修复受损组织和调节免疫功能,在治疗激素治疗失败的急性移植物抗宿主病(aGVHD)方面显示出显著的疗效和安全性,这就是它入选优先审批名单的原因。
03 被纳入优先审批品种名单意味着什么?
被列入优先审评品种名单的主要目的之一是加快药品上市进程。当一种药物被列入优先审评品种名单时,它将获得在药品审评审批过程中的优先处理权。这意味着相关部门将优先审查和批准该药物,以确保其尽快完成相关流程。
审评审批的优先处理,加速上市进程
优先审批机制可以显著缩短药物从申请到最终批准的时间。有数据显示,2020 年 7 月以来,纳入优先审批的药品平均审批时间为 28.2 天,最快仅 2 天,最慢仅 150 天。
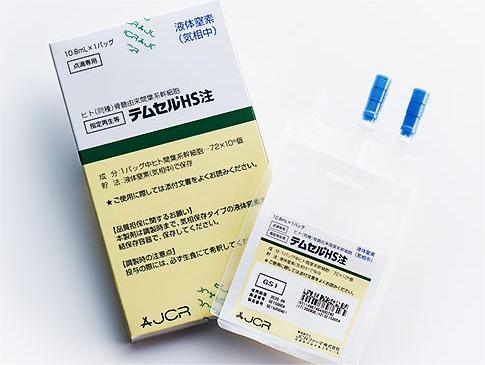
目前在国际上,美国、韩国、日本、欧盟等均已有经批准的干细胞治疗产品上市。2016 年 2 月,日本间充质干细胞注射 temcell 的价格为每袋 868680 日元(每疗程 8 袋,成年患者预计需要 2-3 个疗程,费用约为10-15 万美元)。
政策和技术支持
国家药品监督管理局会为纳入优先审评品种名单的药品提供更多的技术指导和政策支持。这包括优先安排审评资源、加快审评速度、提供必要的审评支持等。
在细胞治疗发展的各个阶段,政策的支持、监管和引导均发挥着重要的作用,并推动着细胞疗法从无序走向有序并逐渐发展成熟。
资源倾斜
将在这些药物的评估中投入更多的专家资源和技术专长,以确保其高效、快速地获得批准。
04 艾米迈托赛注射液上市时间预期
如果一切顺利,根据优先批准的平均时间,艾米迈托赛注射液预计将在几个月内获得市场批准。对于急需新疗法的患者来说,这无疑是一个令人兴奋的消息。特别是对于激素治疗失败的急性移植物抗宿主病(aGVHD)患者,他们将能够在国内获得这种新的治疗选择。
与这些高昂的国际价格相比,艾米迈托赛注射液的预期价格应该低得多,这将大大减轻患者的经济负担,并使更多的患者能够负担得起这种创新疗法并从中受益。
艾米迈托赛注射液(人脐带间充质干细胞)成功纳入优先审批品种名单,标志着其离正式上市又近了一步。这一消息不仅为医药行业注入了新的活力,也给患者带来了新的希望。我们期待更多像艾米迈托赛这样的创新药物在未来尽快问世,为人类健康事业做出更大贡献。
免责声明:我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
