目前,免疫疗法可以通过重新刺激 T 细胞的活性并增强其抗肿瘤作用来治疗癌症。这种疗法帮助特定类型肿瘤的患者延长了生存期,但由于免疫疗法对 T 细胞的持续刺激,T 细胞逐渐发展为功能衰竭,限制了其进一步的抗肿瘤作用。这是免疫疗法目前面临的一大挑战。
当 T 细胞衰竭发生时,多能前体 T 细胞逐渐转化为终末分化的 T 细胞,而后者对免疫检查点抑制剂没有反应,这也是免疫疗法逐渐产生耐药性的原因。科学家们正试图破译 T 细胞衰竭的分子机制,并进行干预,使免疫疗法更有效、更持久。
近日,美国圣裘德儿童研究医院的一个研究小组在 Science 杂志上发表了一项重要研究成果,揭示敲除 ASXL1 基因可以显著增强 T 细胞的抗肿瘤作用,为开发更有效的 T 细胞免疫疗法提供了新思路。

长期 T 细胞刺激可导致功能衰竭,这是限制基于 T 细胞的免疫治疗持续性的主要因素之一。在抗肿瘤过程中,T 细胞逐渐从多能前体状态(Tpex)转变为终末分化状态(Tex),处于 Tex 状态的 T 细胞对免疫检查点阻断(ICB)治疗没有反应。研究人员意外发现,一组骨髓增生异常综合征(MDS)患者在接受抗 PD-L1 治疗后,生存期显著延长。进一步的研究发现,ASXL1 基因在这些患者的 T 细胞中发生了突变。
ASXL1 基因与另外两个基因(DNMT3A 和 TET2)一样,是克隆性造血(CH)的调节因子,与造血干细胞存活优势的增加有关。研究人员推测,这些基因的变化可能会影响 T 细胞的分化过程,从而影响抗 PD-L1 治疗的有效性。
为了验证这一假设,研究人员使用 CRISPR 技术敲除小鼠 T 细胞中的 DNMT3A、TET2 和 ASXL1 基因,并将这些修饰的 T 细胞植入小鼠体内,使其暴露在持续的病毒感染环境中。实验结果表明,当这些特定基因被敲除时,T 细胞会持续受到刺激并分裂长达一年,但它们没有表现出任何功能异常,而是表现出干细胞样状态特征。
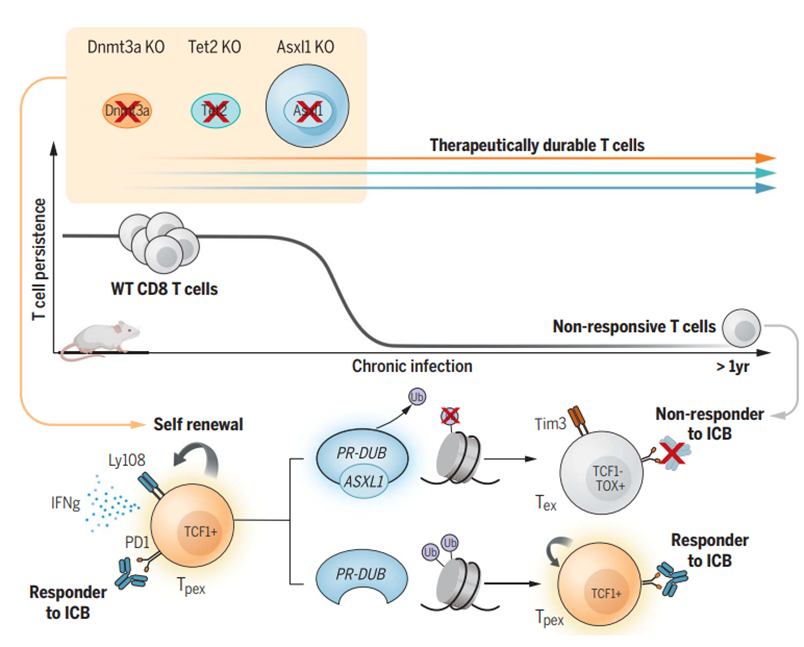
在研究中,ASXL1 基因的作用尤为突出。敲除 ASXL1 基因不仅可以使 T 细胞更活跃地增殖,还可以保持更高的干细胞特性。这些细胞在面对抗原时仍然可以表现出强大的效应器功能,并且可以在更长的抗原刺激时间内保持干性而不会发生恶性增殖。
在感染淋巴细胞性脉络丛脑膜炎病毒(LCMV)的小鼠模型中,作者将这些修饰的T细胞引入小鼠体内,使其受到长期抗原刺激。在 LCMV 感染 30 天后,作者仍然能够在小鼠脾脏中获得大量具有干燥特征的 ASXL1 KO T 细胞,这些细胞在面对抗原时表现出很强的效应功能。在较长的抗原刺激时间内,这些 T 细胞可以保持干燥而不会恶性增殖。
随后,研究人员构建了一批黑色素瘤和癌症小鼠模型,这些模型通常具有较强的免疫抑制作用。他们还将 ASXL1 基因敲除T细胞注射到小鼠体内,随后对一些小鼠进行抗 PD-L1 治疗。首先,单独获得 ASXL1 KO T 细胞足以帮助小鼠进行抗肿瘤治疗并延长存活时间。在添加抗 PD-L1 治疗后,可以进一步控制肿瘤的发展。与仅含有野生型 T 细胞的小鼠相比,含有 ASXL1 KO T 细胞的肿瘤小鼠对免疫疗法的反应更持久。作者发现,ASXL1 KO T 细胞在一年后仍然可以在小鼠体内维持一小部分,避免 T 细胞衰竭,并且仍然具有抗肿瘤特性。
该研究的共同通讯作者 Ben Youngblood 博士指出:“ASXL1 就像一个调节T细胞末端分化的表观遗传检查点,新的研究结果有望帮助我们开发和设计更耐用的抗肿瘤 T 细胞。”
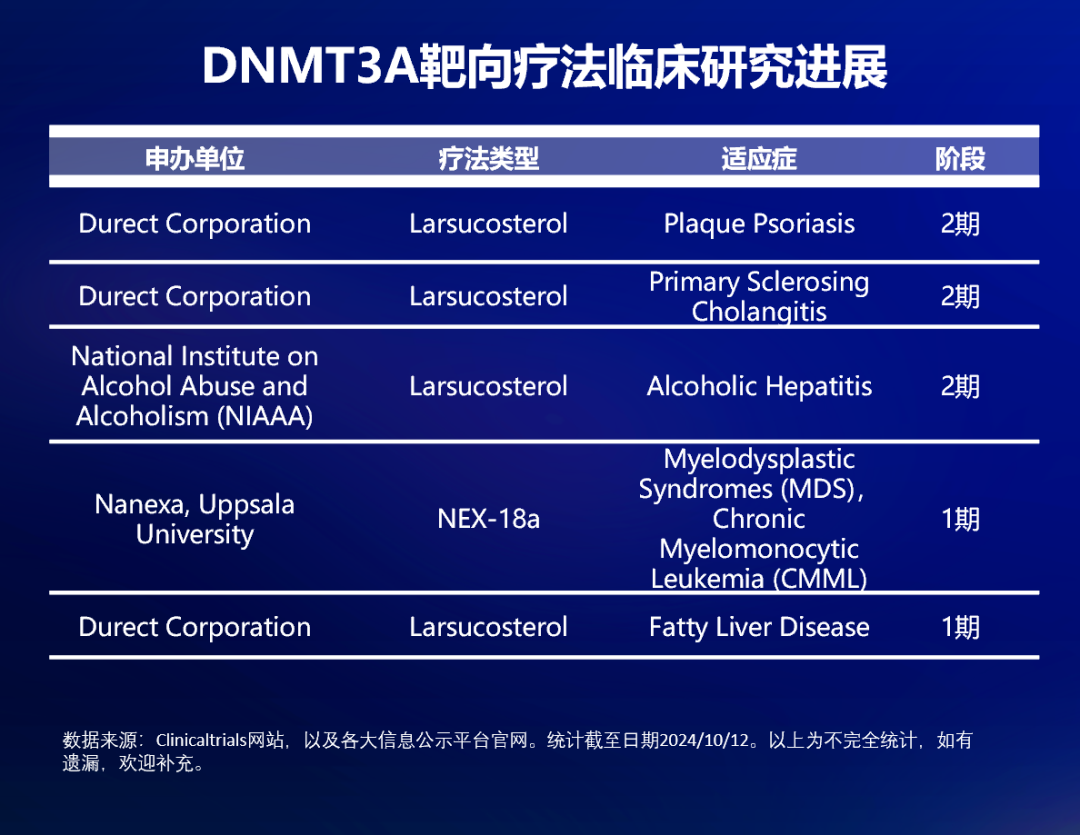
值得一提的是,新的研究还发现,在没有 DNMT3A 和 TET2 的情况下,T 细胞可以获得更强的增殖能力,并对抗 PD-L1 治疗产生有效反应。目前,ASXL1 和 TET2 的靶向研究处于临床前阶段,而 DNMT3A 的靶向性研究取得了一些临床进展。
免责声明:我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
