随着国内外制药公司在研发方面的不断努力,全球细胞治疗赛道正加速进入收获期。
近日,复星凯特宣布发布其 CAR-T 产品阿基仑赛注射液(商品名:奕凯达®)用于治疗一线免疫化疗无效或一线免疫化疗后 12 个月内复发的成人大 B 细胞淋巴瘤(r/r LBCL)的上市注册申请最近获得了国家药监局附条件批准。这也标志着奕凯达®二线适应症正式上市。

随后,国家药监局批准了驯鹿生物申报的 BCMA CAR-T 产品伊基奥仑赛注射液(商品名:福可苏®),该产品在市场上用于治疗既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)的复发或难治性多发性骨髓瘤(RRMM)成人患者。这是国内首个获批的 BCMA 靶向 CAR-T 疗法,也是国内首款自主研发获批上市的 CAR-T 产品。
除了获准在肿瘤领域上市外,细胞治疗在糖尿病领域也取得了突破。美国食品和药品监督管理局(FDA)最近宣布,已批准 CellTrans 公司开发的同种异体胰岛细胞疗法Lantidra上市,用于治疗 I 型糖尿病。根据公开信息,Lantidra 是一种将供体胰腺细胞输送到肝脏主静脉的单次输注药物。接受这种治疗的患者必须服用免疫抑制药物,以防止其免疫系统损伤分泌胰岛素的供体细胞。目前,Lantidra 被批准用于那些尽管进行了严格的糖尿病管理但仍反复出现严重低血糖的 I 型糖尿病患者。

在该消息宣布后不久,礼来与其糖尿病细胞治疗合作伙伴 Sigilon Therapeutics 联合宣布,礼来将以超过 3 亿美元的价格收购后者。Sigilon 是一家致力于为各种急性和慢性疾病患者开发功能性治愈疗法的公司。

从跨国糖尿病巨头礼来的布局来看,细胞疗法在糖尿病市场前景可观。华中科技大学血液病学研究所副所长梅恒在接受 21 世纪经济报道记者采访时表示,细胞疗法在代谢性疾病方面具有巨大的市场潜力。
“糖尿病是胰岛细胞出了问题,无论是哪种类型的胰岛细胞,它们都与免疫功能的异常有关。如果免疫功能细胞被敲除,胰岛功能可以重建,代谢性疾病也得到了有效治疗。如果说抗体药物在上个世纪改变了治疗方法,那么在这个时代,精准的过继性细胞免疫疗法可能为治疗带来新的突破。”梅恒说。
糖尿病迎来细胞疗法
糖尿病是世界上导致死亡和残疾的第八大原因,影响着各国、各年龄组和不同性别群体。全球这种疾病患者数量的指数级增长对全世界公共卫生和医疗保健系统构成了紧迫的挑战。
英国《柳叶刀》周刊和《柳叶刀·糖尿病与内分泌学杂志》最近发表的一系列关于全球和美国糖尿病问题的文章指出,到 2050 年,全球糖尿病患者人数预计将超过 13.1 亿,这将在未来几十年产生持久影响,包括种族和地理区域在内的全球结构性不平等正在迅速加剧这场危机。糖尿病作为一个重大的全球公共卫生问题,给医疗保健系统带来了沉重的负担。此外,根据国际糖尿病联合会的数据显示,2021 年糖尿病导致的全球卫生支出约为 9660 亿美元;预计到 2045 年,这一数字将超过 10540 亿美元。
I 型糖尿病是一种慢性疾病,通常发生在儿童和年轻人身上,它是由自身免疫系统攻击胰岛素产生细胞,导致胰岛素缺乏而引起的。目前,一些 I 型糖尿病患者在使用胰岛素预防高血糖时,往往会纠正到过低的血糖水平,从而导致低血糖。有些人可能会出现无意识低血糖,他们可能无法注意到血糖下降,因此无法采取干预措施防止血糖进一步下降。
美国食品药品监督管理局生物制品评估与研究中心的 Peter Marks 在一份新闻稿中表示,患者严重低血糖是非常危险的,可能会导致意识丧失或癫痫发作,从而造成伤害。基于此,FDA批准的首个治疗 I 型糖尿病的细胞疗法有望为 I 型糖尿病患者和复发性严重低血糖患者提供更多的治疗选择,从而帮助患者达到理想的血糖控制水平。
公开资料显示,Lantidra 细胞疗法是从捐赠者那里提供胰腺组织,然后分离纯化胰岛细胞。目前,临床上 90% 的胰岛移植手术是经皮肝门静脉穿刺注射胰岛细胞,肝脏是这些移植物的新家园,存活的胰岛细胞可以独立调节血糖水平。术后免疫抑制治疗是必要的。
FDA 对 Lantidra 细胞疗法的批准主要基于两项临床试验。在这两项试验中,30 名参与者接受了一到三次药物注射。大约 70% 的人在 1年或更长时间内不再需要注射胰岛素,30% 的人在 5 年以上的时间内不再不需要注射胰岛素。
在 Lantidra 获批上市之际,许多公司也在加快布局。美国国立卫生研究院临床试验注册网站 ClinicalTrials 显示,截至目前,全球正在开展 351 项细胞治疗糖尿病的临床试验。
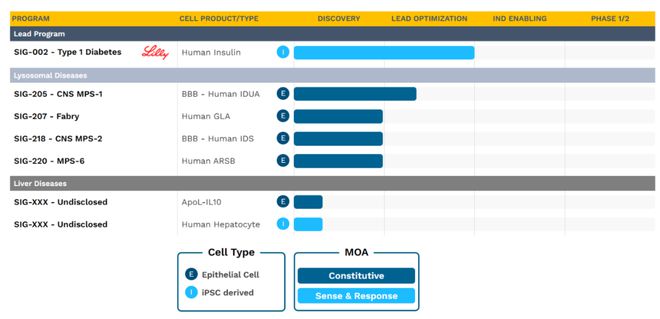
其中,礼来的合作伙伴 Sigilon Therapeutics 是强劲的布局者之一。早在 2018 年,礼来就向 Sigilon 提供了 6300 万美元的初始投资和股权投资,将其研究疗法开发成 I 型糖尿病的功能性治疗。SIG-002 是礼来与 Sigilon 合作的主要资产,预计将在今年 IND 之前完成验证研究,并于 2024 年提交给 IND。
根据此次公开收购的条款,礼来将以每股 14.92 美元的价格收购流通股票,外加每股 111.64 美元收购不可交易的有价值权利,交易总额超过 3 亿美元。消息公布后,Sigilon 的股价在交易前飙升了 470%。这笔交易预计将于今年第三季度完成。
一位券商医药行业分析师对 21 世纪经济报道记者表示,考虑到 2021 年中国糖尿病药物市场规模已达到 670 亿元左右,跨国药企掘金 I 型糖尿病市场的前瞻性值得肯定。面对糖尿病领域巨大且未得到满足的治疗需求,糖尿病患者需要“更好的药物”。然而,由于细胞治疗药物的高昂价格,既有高昂的定价体系,也有巨大的市场需求。作为一种高价药,如何将其商业化,进一步抢占市场份额,也将成为企业未来需要关注的焦点。
创新疗法落地商业化难度大
在糖尿病布局上,除了细胞治疗,礼来还持有 Trulicity(度拉糖肽)、Mounjaro(替尔泊肽)、Humulin(重组人胰岛素)、Humalog(赖脯胰岛素)和Jardiance(恩格列净)。根据礼来公司发布的 2022 年财报数据显示,该公司全年总收入为 285.41 亿美元,同比增长 1%。糖尿病业务组合贡献了 138.29 亿美元的收入,占礼来总收入的 48.5%。
但需要注意的是,礼来 GLP-1 受体激动剂度拉糖肽的增长率自 2021 年以来有所下降。其竞品诺和诺德 GLP-1 业务的年收入为 833.71 亿丹麦克朗(约合 122.44 亿美元),同比增长 56%。此外,有业内人士认为,到 2030 年,I 型糖尿病的市场规模有望超过 70 亿美元,礼来自然不会缺席,细胞治疗的布局也将成为礼来糖尿病新的市场增长点。
然而,细胞治疗市场并不像想象中那么容易。在谈到细胞治疗的市场前景时,一位药企高管在接受 21 世纪经济报道记者采访时表示,在临床治疗领域,细胞治疗肯定会成为越来越主流的治疗方法,但目前行业发展还处于早期阶段。细胞治疗是一种技术复杂、生产成本高、相对个性化的治疗方法,对于患者的可及性和整个市场的未来规模方面还存在一些不确定性。
根据弗若斯特沙利的数据,自 2015 年以来,全球细胞治疗行业一直在快速发展。从 2016 年到 2020 年,市场规模从 5040 万美元增加到 20.8 亿美元,预计到 2025 年,全球细胞治疗市场规模将达到近 305.4 亿美元。尽管在中国进行的临床研究很多,但在中国推出并商业化的产品很少,这也反映了研究和产出之间的不平衡。
此外,据沙利文统计,截至 2022 年 11 月底,国家药品监督管理局已批准 200 多个用于细胞基因治疗的新药临床试验许可证,但只有极少数推进至注册临床 II 期或关键临床研究阶段。细胞治疗药物的适应症分布也集中在癌症领域。如何在竞争中脱颖而出,快速推进注册临床研究,并在未来取得商业成功,是许多企业需要考虑的重要问题。
从研发渠道来看,医药行业约 13% 的产品属于细胞疗法,但目前产品数量不足 1%。该行业仍处于快速增长阶段,是继小分子和大分子之后的跨代类别。例如,我们还需要关注细胞治疗产品扩展在新适应症和工艺创新方面的进一步突破。这家制药公司的高管强调,细胞治疗的成本仍然很高,提高患者的用药可及性仍然是一个主要方向。下一步,需要进一步关注扩大市场应用前景,行业需要在肿瘤的基础上进一步探索更多疾病领域的发展可能性。
此外,上海药品审评核查中心副主任李香玉此前指出,细胞治疗产品已经走过了业内人士质疑其安全性和有效性的阶段。在企业开发的细胞基因治疗产品的安全性和有效性得到提高后,近年来批准的基因治疗产品数量有所增加。在现有的细胞治疗市场中,绝大多数商业化和市场化的细胞治疗产品都是针对相对集中的靶点,这也引起了人们对差异化靶点产品的关注。
“需要注意的是,国家层面对细胞基因治疗产品的监管也越来越严格。例如,细胞治疗产品的 GMP 与传统生物制品相比具有一定的特异性,例如一次性装置的数量多,并且生产过程应注重剪切力。此外,还要考虑细胞的稳定性、工艺的稳定性和供体的变异性。”李香玉强调。
公司如何应对这些情况?上述分析师还指出,中国细胞治疗产品之所以无法进入红海市场,是因为与抗体药物和化学靶向药物相比,研发壁垒相对较高。然而,许多制药公司在申报注册临床-注册临床-获批上市等各种环境中都面临着工艺壁垒。这也使得不少药企因为工艺不过关最终在审评环节终止,浪费了大量的精力和资源。此外,目前细胞治疗的总体渗透率高于预期,但总体渗透率仍然很低。因此,企业在这一赛道上的布局仍需综合考虑。
免责声明:
我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
