近日,细胞治疗先驱企业 Mesoblast 宣布,FDA 接受了该公司为间充质干细胞疗法 remestemcel-L 重新递交的生物制品许可申请(BLA),用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿科患者。如果获得批准,该疗法将成为 FDA 批准的首款“现货型”细胞疗法,并且是治疗 12 岁以下 SR-aGVHD 儿童的首个获批疗法。

01 关于 Mesoblast
Mesoblast 是开发同种异体(现货)细胞药物的世界领先者。该公司利用其专有的间充质谱系细胞治疗技术平台,建立了广泛的后期候选产品组合,这些候选产品通过释放抗炎因子来对抗和调节免疫系统,从而对严重炎症做出反应,减少体内破坏性炎症的发生。
Mesoblast 拥有强大而广泛的全球知识产权组合,旗下所有产品的主要市场保护期至少延长至 2041 年。该公司的专有制造工艺可冷冻保存、规模化生产现成的细胞药物。这些细胞疗法具有明确的药用标准,计划随时可供全球患者使用。

02 关于 Remestemcel-L
Mesoblast 的主要候选产品 remestemcel-L 是一种经过培养和扩增的间充质干细胞,这些细胞来源于骨髓捐献,移植方式是通过静脉输注给药于患者。
Remestemcel-L 被认为具有免疫调节特性,可通过下调促炎细胞因子的产生、增加抗炎细胞因子的产生以及募集天然存在的抗炎因子来抵消 SR-aGVHD 中涉及的炎症过程细胞和受累组织。
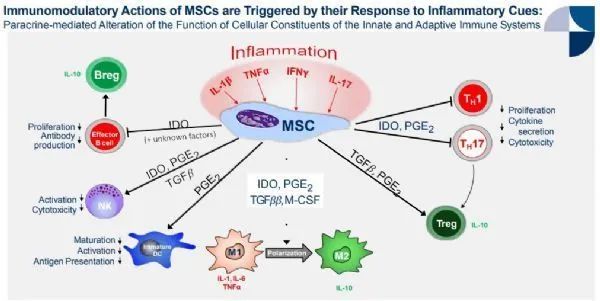
▲ 间充质干细胞的抗炎和免疫调节机制
03 关于移植物抗宿主病(GVHD)
大约 50% 接受同种异体骨髓移植(BMT)的患者会发生急性 GVHD。全世界每年有超过 30000 名患者接受同种异体 BMT,主要是治疗血癌,其中约 20% 是儿科患者。SR-aGVHD 的死亡率高达 90%。目前仍然缺乏针对 12 岁以下儿童的任何合法的治疗方案,这意味着迫切需要一种能够改善惨淡生存结果的疗法。
04 关于 Remestemcel-L 的上市之路
2020 年 1 月,Mesoblast 递交了该产品的上市申请。
2020 年 8 月,Remestemcel-L 治疗类固醇难治性急性移植物抗宿主病儿童患者的疗效获得美国 FDA 肿瘤药物咨询委员会 9:1 的压倒性支持,该事件也受到了医疗界的广泛关注。而 FDA 最终驳回了 Mesoblast 的上市文件,尽管其咨询委员会投票认为其临床数据能够支撑上市,但 FDA 要求该公司提供更多临床数据,至少包括一项额外的随机临床试验数据。
据悉,在初次递交数据时,Remestemcel-L 已经过了 10 余年的临床研究,其中主要研究项目有三项:
● GvHD001/002 研究
GvHD001/002 研究是一项在美国 20 个试验站点开展的涉及 55 名儿童的 3 期单臂试验,Remestemcel-L 被作为一线疗法,以治疗类固醇疗法无效的儿童 aGvHD 患者。与 275 研究的研究结果一致,该研究第 28 天总缓解率达到 70%,与预先指定的 45% 控制值(70.4% VS 45%,P=0.0003)相比,这更具有统计学意义。
● 275 研究
该项研究覆盖了 8 个国家/地区的 50 个中心,纳入了 241 名儿童 SR-aGvHD 患者,主要终点是第 28 天的总反应(OR) 在 65% 的患者中实现。试验结果显示,第 100 天的总体存活率为 67%,其中没有达到第 28 天 OR 的患者第 100 天的总体存活率为 39%,相比之下,达到第 28 天 OR 的患者 100 天内的存活率更高,达到 82%。
● 280 研究
该研究是一项在 7 个国家/地区的 72 个试验站点进行的,涉及 260 名患者(其中包括 28 名儿童)的 3 期随机安慰剂对照试验,Remestemcel-L 或安慰剂作为二线治疗,以治疗 SR-aGvHD 患者。在疾病程度最严重的儿童和成年患者中,与安慰剂组相比,Ryoncil 治疗组第 28 天总缓解率达到 58%,对照组为 37%。在标准风险患者中,Ryoncil 治疗没有显著的益处。该研究的儿童患者中,Ryoncil 治疗组与安慰剂组相比,第 28 天总缓解率明显更高,达到 64%,而安慰剂组为 36%。

▲ Mesoblast候选产品及进展阶段
从首次递交到现在已经过了 3 年,这三年里 Mesoblast 多次与 FDA 沟通上市事宜,多次被拒。此次递交的试验数据终于得到了 FDA 认可,FDA 认为此次重新提交的数据是一个完整的数据,并将处方药用户费用法案(PDUFA)日期定为 2023 年 8 月 2 日。
此次递交的新的试验数据,包括来自高风险儿童的倾向性匹配研究,数据将3期试验中 25 名接受 remestemcel-L 治疗的儿童的疗效数据与西奈山医院数据库中 27 名未接受 remestemcel-L 治疗的儿童进行了比较。分析显示,67% 的 remestemcel 治疗患者在 28 天内反应积极,六个月后存活,而数据库中只有 10% 的患者具有相同的结果。
在重新补充提交的数据中,还包含国际血液和骨髓移植研究中心(CIBMTR)对参加 3 期试验的 51 名可评估 SR-aGVHD 患者进行的 4 年生存研究的结果。结果证明了早期 180 天生存获益的持久性,在一组主要患有 C/D 级疾病的儿童中,1 年生存率为 63%,2 年生存率为 51%。历史上这些患者的 2 年预期生存率为 25-38%。
新数据可以充分证明生产工艺的一致性和可重复性,以及根据广泛的临床数据建立新的商业产品发布规范,从而保证未来每个批次的 remestemcel-L 的稳定性。
基于现有研究数据,FDA 授予了 remestemcel-L 快速通道指定。Mesoblast 颇为艰难的上市之路也给了我们一定的信号:即使疗效得到了认可,即使所针对的疾病仍然处于一种无药可治的状态,但 FDA 对于干细胞这种新兴的治疗技术仍然持一种相对保守的态度。
在这三年多的时间里,Mesoblast 百折不挠,不断地与 FDA 进行“沟通”,FDA 不断地给到一些建议,然后 Mesoblast 根据这些建议不断地改进临床试验或是做新的试验,最终补足了 FDA 所要求的试验数据才得以再度申报上市。这反映了新的治疗手段想要获批必须得到充分的疗效和安全性数据验证,且必须注重和监管机构的沟通。
免责声明:
我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
