近年来,细胞和基因治疗显示出巨大的辉煌,在不久的将来,批准的细胞和基因疗法产品数量将急剧增加。2019 年初,美国食品药品监督管理局宣布了未来细胞治疗的发展计划。预计到 2025 年,该领域每年将有 10-20 种新药获批,包括细胞和基因治疗产品。近日,据外媒报道,预计到 2023 年底,美国、欧洲或两者将批准 13 种新的细胞或基因疗法。

随着 CRISPR 等基因组编辑技术的出现和人们对免疫学认识的加深,以及特殊生物样品和材料的培养、制造、运输、储存和加工的优化,细胞治疗领域正在发生革命性的变化。
目前,CAR-T 等免疫细胞疗法为一些肿瘤的治疗带来了新的选择。然而,细胞技术的发展和不同干细胞的应用,如脂肪干细胞、间充质干细胞和诱导多能干细胞,将为神经系统、肌肉骨骼和皮肤病等肿瘤以外的疾病提供更好的选择。
细胞疗法的独特应用和治疗优势
细胞疗法是一种以细胞为基础,以活细胞为活性药物治疗疾病的治疗方法。细胞疗法是目前临床上最有前途的治疗方法,有可能治愈多种难治性疾病。与其他疗法相比,细胞疗法具有独特的临床应用和治疗优势。
首先,活细胞可以动态消除恶性肿瘤,再生组织细胞,恢复受损的组织功能,并根据自身情况增加身体抵抗疾病的能力。
其次,活细胞可以对系统和局部的化学、物理和生物变化做出反应。
此外,活细胞更容易突破生物屏障,实现精确的分子靶向功能,准确定位细胞和组织,并与其相互作用以实现治疗功能。
全球细胞疗法的发展概况
目前,全球细胞治疗市场主要由干细胞、组织特异性细胞和血细胞组成。
干细胞疗法
目前,批准用于临床的干细胞疗法包括造血干细胞(HSCs)、间充质干细胞(MSC)和角膜缘干细胞(LSCs)。造血干细胞(HSC)产品主要被批准用于治疗血液疾病。间充质干细胞(MSCs)治疗适用于多种疾病,包括心血管疾病、移植物抗宿主病(GvHD)、退行性疾病、炎症性肠病和其他难治性疾病。角膜缘干细胞(LSC)产品仅被批准用于角膜缘干细胞缺陷。

▲ 全球获批上市的近 20 款干细胞产品
组织特异性细胞疗法
组织特异性细胞主要用于再生医学和组织工程,如用于治疗热烧伤的自体皮肤细胞(即角质形成细胞、成纤维细胞和黑素细胞),用于治疗糖尿病下肢静脉溃疡和足溃疡的双层活细胞皮肤替代物,以及用于修复软骨缺损的自体软骨细胞支架。
血细胞疗法
包括白细胞、红细胞和血小板。然而,目前只有 T 细胞和 DC 细胞被批准用于临床治疗。大多数 T 细胞产物是嵌合抗原受体(CAR-T)治疗恶性血液病,而 DC 细胞治疗被用作癌症疫苗。
根据近年来全球细胞治疗临床研究综述,五年前针对间充质干细胞的临床试验和研究数量排名第一。近年来,对单个 T 细胞进行测试的研究数量远远超过了对所有干细胞和组织特异性细胞的研究数量。这一重大转变主要是由于 CAR-T 疗法的成功临床应用(见下图)。从统计数据来看,T 细胞主导了当前细胞治疗的临床研究,其次是干细胞、树突状细胞、自然杀伤细胞、微生物、红细胞、单核细胞和血小板。
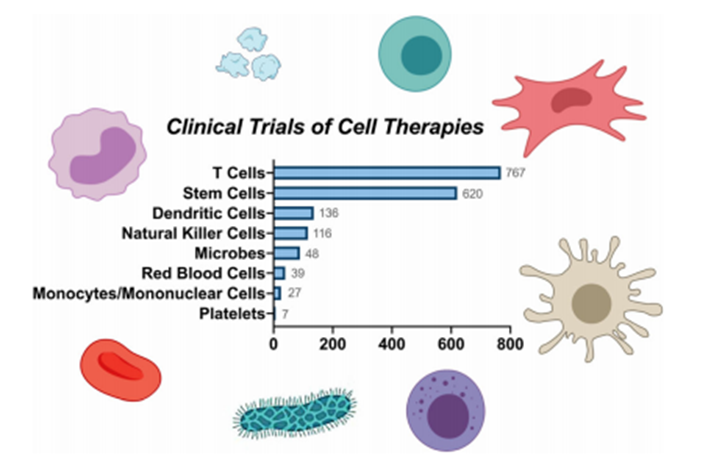
▲ 临床试验中的各种类型的细胞疗法
全球 T 免疫细胞治疗的发展概况
截至目前,全球市场上共有 7 种 CAR-T 免疫细胞治疗产品。
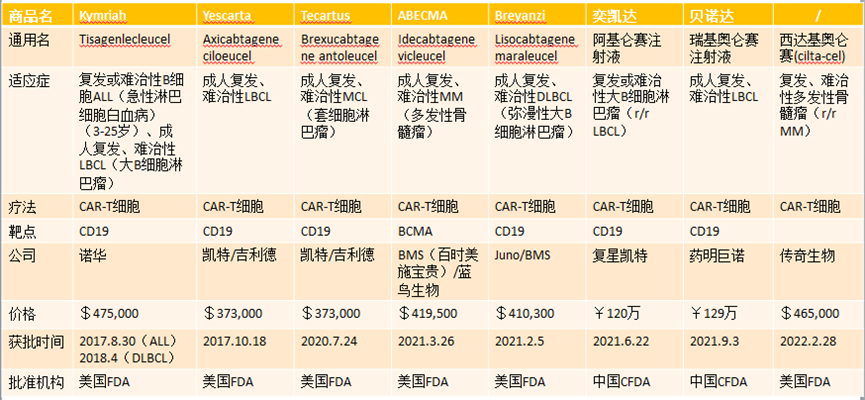 此外,其他 T 细胞疗法已被用于治疗实体瘤。
此外,其他 T 细胞疗法已被用于治疗实体瘤。
ImmunCell-LC 于 2007 年获得 KFDA 批准,是一种基于自体细胞因子诱导杀伤(CIK)细胞的免疫疗法。主要用于肿瘤切除后的辅助治疗。它可以通过去除残留的肿瘤细胞来治疗肝细胞癌、脑肿瘤和胰腺癌症。
目前,T 淋巴细胞治疗的临床试验如下图所示。T 淋巴细胞是所有细胞治疗试验中研究最多的细胞类型,占所有试验的 45%。根据它们的状态,它们被分为转基因(GM)和非转基因(NGM)。转基因(GM)细胞根据其受体类型分为嵌合抗原受体(CAR)和 T 细胞受体(TCR),而非转基因(NGM)细胞则根据其靶标类型分为靶向肿瘤相关抗原(TAA)和病毒抗原(VST)。如果没有明确的受体或靶标,则将其归类为“其他”。
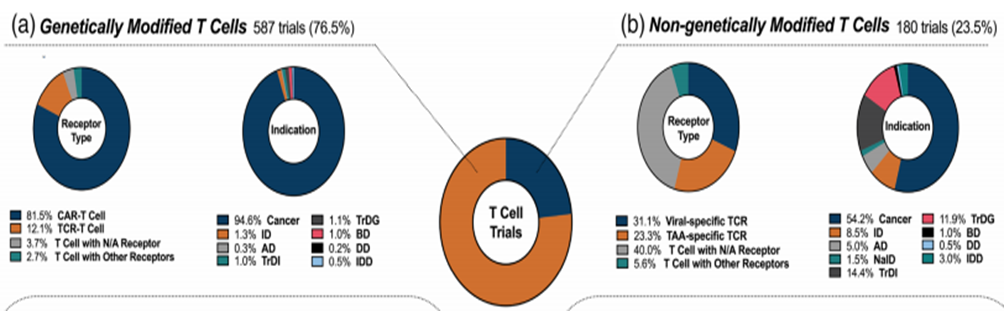
▲ T 细胞临床试验的现状
如图所示,在目前针对 T 细胞的临床试验中,转基因(GM)T 细胞占 76.5%,而非转基因(NGM)T 细胞约占 23.5%。转基因类别试验根据转基因受体的类型进一步分类。其中,靶向 CAR-T 细胞治疗的临床试验占转基因(GM)T 细胞的 81.5%,TCR-T 细胞的 12.1%,具有不适当受体(N/A)的 T 细胞的 3.7%,其他 T 细胞受体的 2.7%,TAA 特异性 T 淋巴细胞的 23.3%,具有不当受体(N/A)的 T 细胞的 40.0%,以及其他 T 细胞靶点的 5.6%。
CAR-T 细胞治疗
目前,绝大多数已批准的 CAR-T 疗法都专注于 CD19 靶点。此外,BCMA、CD22 和 CD20 也已成为流行的靶点。
由于缺乏明确的细胞外抗原靶点、T 细胞浸润不足以及难以克服免疫抑制的肿瘤微环境,CAR-T 治疗在实体瘤中仍然是一个巨大的挑战。目前,约 24% 的临床试验靶点仍用于实体瘤。最常见的靶点是 GD2(神经母细胞瘤和黑色素瘤)、HER2(转移性乳腺癌)和 GPC3(癌症)。
除了研究不同的肿瘤细胞外抗原靶点外,CAR-T 细胞治疗的不同给药方法也是研究热点。目前,CAR-T 治疗的主要给药途径仍然是静脉给药,而其他给药途径也在研究中,如腹膜内、肿瘤内、肝内动脉、胰腺内和胸膜内给药。不同的给药方法可能在预防 T 细胞衰竭、提高靶点特异性和促进组织浸润方面具有优势,这可能会增加 CAR-T 目前在实体瘤治疗中的应用。
TCR-T 细胞治疗
TCR-T 细胞疗法通过与 MHC 的有效相互作用激活宿主的免疫系统。与 CAR-T 细胞疗法只能识别肿瘤表面的特异性抗原不同,TCR-T 细胞疗法可以识别细胞内的肿瘤特异性抗原,使 TCR-T 细胞疗法在肿瘤治疗中更有效。NY-ESO-1 是最常见的靶抗原,在许多癌症中表达,包括骨髓瘤、黑色素瘤等。其他肿瘤相关抗原,如 PRAME 和 MAGE 蛋白,黑色素瘤分化抗原 MART-1 和 gp100,以及最近的癌症驱动因素,如 WT1、KRAS 和 TP53,也是流行的 TCR-T 靶点。
病毒特异性 T 细胞(VST-T)治疗
VST 目前正在进行治疗癌症、移植相关疾病和感染的临床研究。VST 可以通过识别 MHC 上的病毒表位来消除病毒诱导的癌症,还可以用于治疗与癌症和/或移植无关的病毒感染,如艾滋病病毒和严重急性呼吸综合征冠状病毒(SARS 冠状病毒 2 型)。
TAA 特异性 T 淋巴细胞治疗
目前,大约 2/3 的 TAA 特异性 T 淋巴细胞疗法被设计用于治疗实体瘤,一些试验目前处于临床试验的第二阶段。
总之,T 淋巴细胞治疗癌症的临床试验目前正在蓬勃发展。T 淋巴细胞疗法不同于传统的治疗疾病的方法,是一种有效的治疗方法,已被 FDA、EMA 和世界各地的其他监管机构批准用于治疗癌症。
然而,仍然存在重大挑战,包括生物来源的安全性和免疫原性、生物功能的异质性、细胞治疗后生物活性的维持、最佳递送方法的选择,以及细胞治疗剂的制造和调节方面的挑战。
随着临床研究的进展,基于 T 免疫细胞的治疗有望成为治疗更多疾病的新选择。
全球细胞治疗监管政策促进发展
从第一次干细胞移植到今天的工程细胞疗法获得批准,花了将近 50 年的时间。随着研究和调控的逐渐发展和成熟,人们可以看到下一代基于细胞的治疗可以在更短的时间内惠及更多患者。目前,世界各地正在采取不同的措施来加快创新新药的审批。
例如,美国食品药品监督管理局有几种加快审批的方法,如再生医学高级治疗资格认证(RMAT)、快速通道资格认证等。美国食品药品监管局表示,未来将加强与产品开发商的沟通与合作,以最大限度地利用这些渠道。
在中国,自 2018 年 11 月以来,中国新药临床试验正式从以前的审批制度转向默示许可,从“点头制”审批转向“摇头制”审批时代,这意味着中国新药临床实验行政许可将进入更高效的审查模式。
在过去几年中,美国、澳大利亚、欧盟、日本、韩国、中国和其他地区已经批准推出新的细胞治疗产品,包括免疫细胞治疗产品和干细胞治疗产品。未来,随着监管、审批和支付方式的逐步完善,这类产品的发布速度将更快,市场渗透率将更大。这意味着更多的患者将能够使用细胞治疗产品。
免责声明:
我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
