国家药监局评审中心日前就《中国食品药品监管》发文,对我国先进治疗药物的范围和分类进行了探索。细胞产品有望跻身先进治疗药物行列!

以细胞和基因治疗产品为代表的先进治疗医疗产品(ATMP),为癌症、遗传病、罕见病等疑难疾病的治疗带来了新的机遇和选择。
根据 Citeline 数据库统计,截至 2024 年 4 月,已有 100 多种基因、细胞和 RNA 产品获准在全球上市,3700 多种产品(包括约 55% 的基因治疗产品和 53% 的细胞治疗产品)处于临床前或临床(约 30%)开发阶段。
尽管中国的先进治疗行业起步较晚,但目前已发展成为全球细胞治疗研发热情最高的地区。根据临床试验的不完全统计。根据政府网站,中国用于细胞治疗的临床试验和申报产品数量位居世界第二,仅次于美国。
自 2021 年中国首个嵌合抗原受体 T 细胞(CAR-T)治疗药物获批以来,中国推出的 CAR-T 产品数量已占全球同类产品的 50% 以上。我国先进加工业发展已进入与国际先进水平并驾齐驱的新阶段。
全球许多国家和地区不断致力于加强 ATMP 监管体系的顶层设计和监管能力建设。美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、日本药品医疗器械综合机构(PMDA)等药品监管机构逐步建立了 ATMP 的监管框架,积极制定和发布相关法规和指南,并不断完善。据不完全统计,到目前为止,全球监管机构已经发布了 400 多项与细胞和基因治疗产品相关的技术指南。一些国家和地区在法律和监管层面明确了此类药物的定义和分类,并制定了激励政策(如特殊审评程序等),以加快产品审批和上市。
中国国家医疗产品管理局(NMPA)目前已发布了 30 多项与该类产品相关的技术指导原则,涵盖研发、注册、工业化生产和上市后变化等各个阶段。在中国,这类产品适用于鼓励创新和加快审批等各种程序。然而,这类药物的分类和定义尚未在法律和监管层面得到明确界定。名称和分类尚未形成行业共识,名称的使用和分类不一致,不利于规范监管、行业沟通和国际协调。
作者认为,分类与产业发展密切相关,明确 ATMP 在中国的分类和定义迫在眉睫。
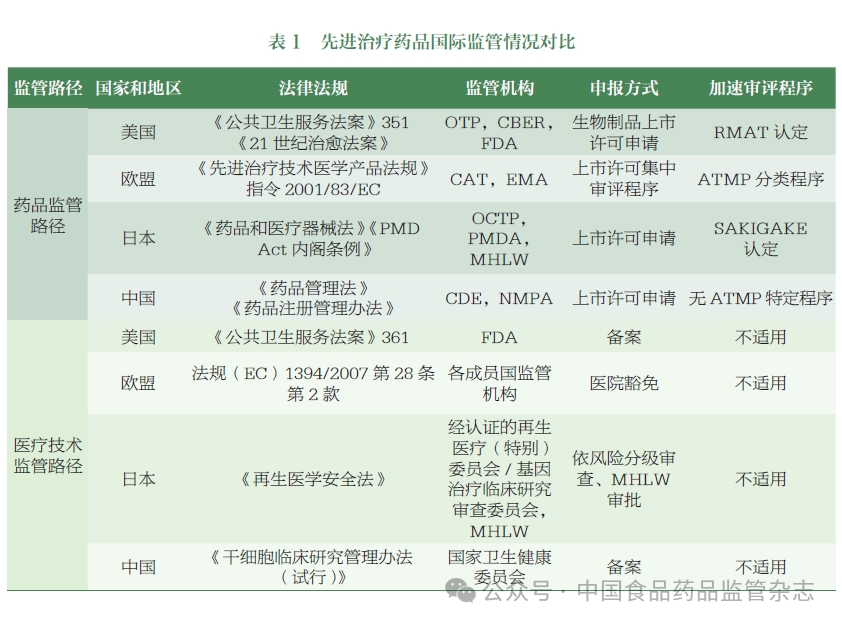
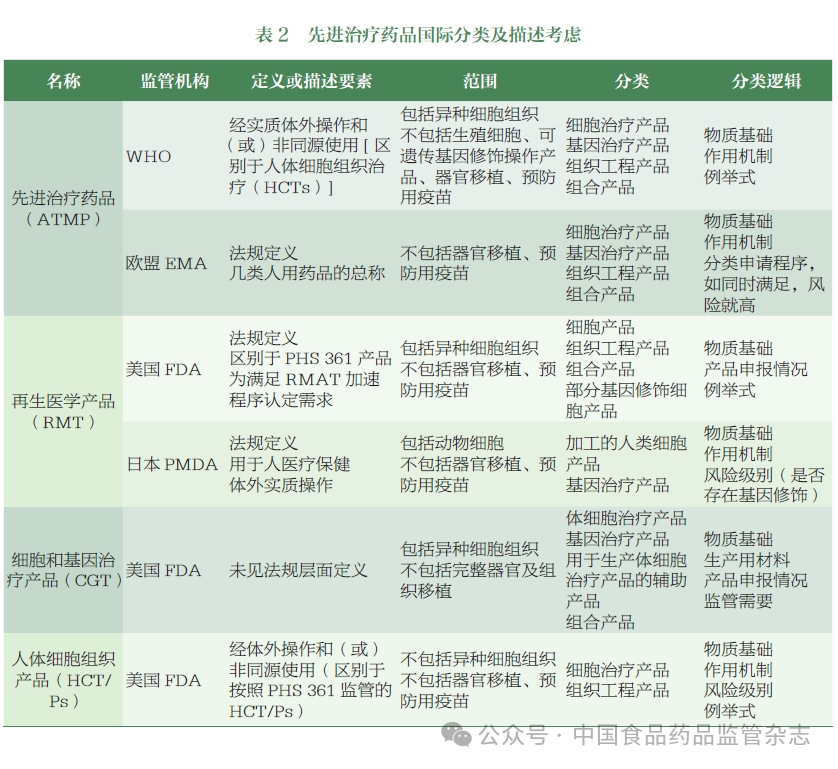 基于国外监管机构对 ATMP 监管分类的研究,CDE 组织相关部门梳理了国内相关产品的应用情况,初步提出了 ATMP 在中国的分类和描述,并举行了专家研讨会,邀请了学术界、行业和监管领域的专家,就名称制定、分类和描述的关键考虑进行了讨论,形成了以下建议。
基于国外监管机构对 ATMP 监管分类的研究,CDE 组织相关部门梳理了国内相关产品的应用情况,初步提出了 ATMP 在中国的分类和描述,并举行了专家研讨会,邀请了学术界、行业和监管领域的专家,就名称制定、分类和描述的关键考虑进行了讨论,形成了以下建议。
名称和描述
参照 FDA、EMA、PMDA及 WHO 等监管机构的命名,结合现阶段国内行业使用的术语,该类产品的名称应主要考虑符合国际标准,同时体现产品的创新性和技术先进性,以鼓励我国相关行业的发展,并具有前瞻性,为未来新兴技术药物预留监管空间。可参考世界卫生组织和欧洲药品管理局考虑通用名称和具体分类,确保通用名称突出药品属性,涵盖大部分相关药品类别,同时做好分类归属细化工作。考虑到“细胞和基因治疗产品”主要反映产品的物质基础,“再生医学产品”主要体现产品功能,相对有限。“先进治疗药物”的覆盖范围相对较广,并与世界卫生组织等国际监管机构协调。建议使用“先进治疗药品”作为此类产品的中文名称,英文名称为“ATMP”。
基于国际监管机构对此类产品的定义和专家意见,作者认为,“先进治疗药品”的描述应考虑物质基础、工艺特点、功能用途等内容。同时,应根据体外操作的程度和使用情况来定义医疗技术相关边界产品的分类。考虑到该类产品受药品监管,作者将以“体外操作”和“功能性使用”作为ATMP的描述元素,并基于我国相关产品申报的现状和未来发展趋势,基于活性成分的多样性和创新性,完善相关描述。它被描述为:“先进的治疗药物是指通过体外操作生产并在体内发挥作用的细胞治疗药物、基因治疗药物或组织工程药物,以及使用其他先进技术/方法生产的创新药物。”ATMP 的生产和研究过程必须符合中国的伦理要求。用于输血的血液成分和用于移植的造血干细胞不在 ATMP 范围内。
在物质基础上,可以考虑包括在中国有大量应用的产品,如细胞治疗产品和基因治疗产品,以及组织工程产品和其他新兴技术产品,为新技术预留接口。从工艺特征上看,结合 FDA、EMA、WHO 等相关定义,通过简单的体外操作制备并同源使用的细胞组织治疗产品不属于 ATMP。因此,基于国际监管实践和产品生产中常见的工艺步骤,作者在说明书中对“体外操作”进行了简单的定义,主要包括分离、纯化、扩增、基因修饰、基因编辑等。未来如有必要,我们将参考美国食品药品监督管理局等监管机构的做法,进一步明确“体外操作“和“同源使用”的定义。在功能用途方面,参考目前国内生物制品的监管现状,考虑到目前申报的产品主要是治疗性生物制品,说明书仅明确说明为治疗性药物,目前不涉及预防或诊断目的。
基于专家建议,作者进一步对涉及生殖细胞使用的医疗技术和产品等边界产品进行了分类和界定。在医疗技术方面,说明书明确排除了输血、器官/组织移植等属于国家卫生健康委员会管理的医疗技术。需要注意的是,这里的移植指的是医疗机构使用的治疗方法,而不是给药途径。例如,用于移植和给药的转基因造血干细胞由于其在体外的复杂生产操作而属于 ATMP 的类别。对于涉及使用生殖细胞和一些可遗传基因改造操作的产品,由于来源和操作多种多样,说明书明确指出需要满足中国的伦理要求。
分类建议
为了增强监管的科学性和有效性,鼓励药物研发的持续创新,结合国际分类、产品物质基础、监管风险水平和国内产品研发申报情况,作者对ATMP分类进行了初步研究,并探讨了分类和相关产品归属的合理性。
ATMP 是目前生物医药领域最有前景和前景的发展方向,在国际竞争和国家战略规划中占有重要地位。临床价值引领、全产业链政策支持、前沿技术创新驱动、持续资金支持、科学严格监管护航,将共同推动我国先进治疗产业高质量发展,培育生物制药新的质量生产力,及时满足人民群众未满足的临床需求。
当前,生物制药行业整体面临资金寒冬,产品管线推进受阻。目前,市场上的产品数量有限,而且价格很高。医疗保险尚未完全覆盖,市场支付能力不足。在药物供应、可及性和可负担性方面仍然存在巨大差距。
因此,监管机构应更多地关注和支持此类产品的研发,并提供更明确的监管政策和激励措施。
本文提供的 ATMP 分类和定义建议使总体分类框架和逻辑与主要国际监管机构的分类系统保持一致。有望为未来监管分类相关配套政策的制定提供参考,并指导相应技术指南、标准体系的完善和国际监管协调,从而进一步提高 ATMP 的监管效率,加快相关产品的研发申请、审批和上市,帮助满足人民群众未满足的临床需求。
免责声明:我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
