癌症是一种系统性疾病,会破坏许多细胞信号和代谢途径,长期炎症是引发癌症的因素之一。炎症是启动肿瘤发展还是支持肿瘤生长取决于环境,肿瘤外的免疫系统在肿瘤进展过程中会发生显著变化。
01 癌症-免疫系统的“捣乱分子”
免疫是由不同组织细胞谱系之间的相互作用调节的。因此,为了提高对肿瘤免疫学的理解,有必要评估肿瘤微环境(TME)之外的系统免疫景观。从治疗策略的开发角度来看,外周免疫系统有必要驱动有效的天然和治疗诱导的抗肿瘤免疫反应。
美国旧金山加利福尼亚大学的研究人员在《Nature Reviews Cancer》上发表了一篇题为“Systemic immunity in cancer”的综述文章,全面总结了癌症中的免疫系统的最新发现。

研究证实,许多人类癌症和癌症小鼠模型都存在造血系统损伤,最显著的表现是肿瘤宿主外围未成熟的中性粒细胞和单核细胞膨胀,然后进入肿瘤微环境,导致局部免疫抑制。
简言之,造血干细胞和祖细胞被动员到单核细胞和粒细胞谱系的增殖和分化中,导致未成熟免疫抑制中性粒细胞(PMN-MDSC)、单核细胞(M-MDSC)和巨噬细胞的外周扩张和肿瘤积聚。
绝大多数强调癌症背景下的外周免疫疾病的研究都集中在未成熟和免疫抑制性髓细胞群体数量的增加上。然而,这种延伸通常与外周免疫谱的许多其他变化同时发生。
除了由于异常造血导致单核细胞和中性粒细胞的过度产生外,在肿瘤宿主的外周还观察到树突状细胞的紊乱。树突状细胞是癌症中 CD8+ 和 CD4+T 细胞起始、分化和增殖的关键协调因子,研究其抗肿瘤免疫反应具有重要意义。
与健康对照组相比,人类卵巢癌、前列腺癌、乳腺癌、肺癌和肾癌以及头颈部鳞状细胞癌和黑色素瘤的外周血中树突状细胞亚群的频率均有所降低。
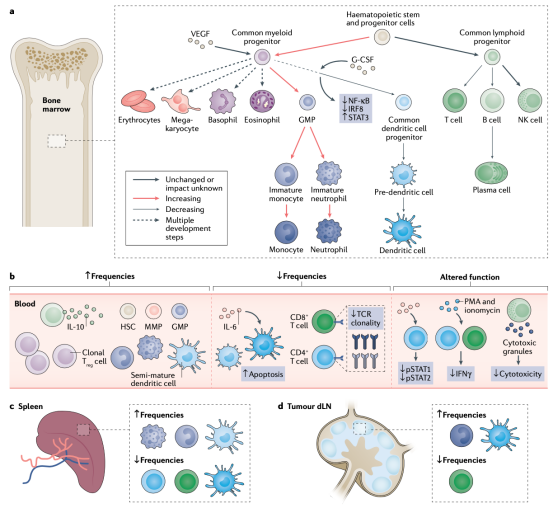
注:肿瘤带来的系统性免疫扰乱
新发现的证据表明,免疫疗法可以驱动新的免疫反应,而不是重振现有的免疫反应。然而,即使在肿瘤微环境之外,癌症患者的新免疫反应也可能受到损害。总之,免疫系统崩溃发生在不同类型的肿瘤中。
02 衰老-悄无声息的侵蚀免疫力
“岁月就像一把杀猪刀”描述了时间侵蚀表面的力量,但事实上,岁月对内在,比如免疫系统,也是杀得毫不手软。
德国哈雷马丁·路德大学的研究人员及其合作者在《OncoImmunology》上发表了一篇题为“T cell receptor next-generation sequencing reveals cancer-associated repertoire metrics and reconstitution after chemotherapy in patients with hematological and solid tumors”的文章,发现 40 岁以上的健康个体就开始出现 T 细胞多样性的下降和 T 细胞克隆性的增加,而且这是一个持续的过程。

为了解决健康个体和癌症患者的免疫衰老的动态和免疫麻痹存在的争议,他们使用二代免疫测序技术研究了健康个体和癌症患者 346 份血液样本中的 T 细胞受体(TCR)指标。
这些分析表明,与健康人相比,未接受化疗的血液肿瘤和实体瘤患者的血液 TCR 库的多样性明显较低,克隆性较高。40岁后,更是呈明显下降趋势。
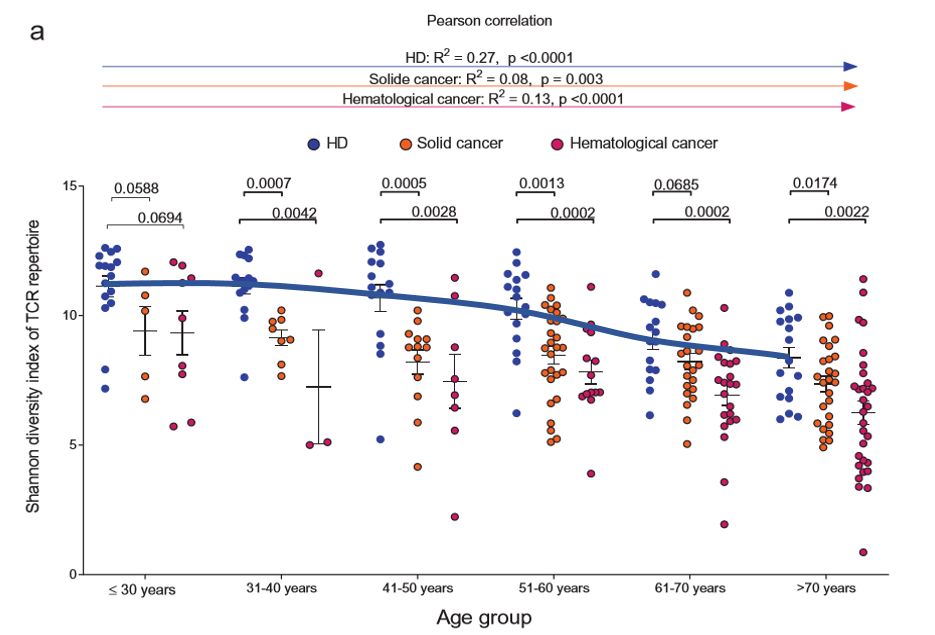
注:图中蓝色线为健康人 T 细胞多样性趋势,从 40 岁开始下降幅度增大
癌症患者 T 细胞更易老化
T 细胞的多样性对于对抗癌症至关重要。不同类型的 T 细胞可以攻击不同类型的癌症细胞,而 T 细胞多样性的降低意味着 T 细胞的多样性正在降低。随着年龄的增长,可以攻击不同类型癌症细胞的 T 细胞数量减少,从而导致疾病和癌症。
在癌症患者中,研究人员还发现,与健康人相比,癌症患者的 T 细胞多样性较低。此外,多样性下降的频率和幅度更快。
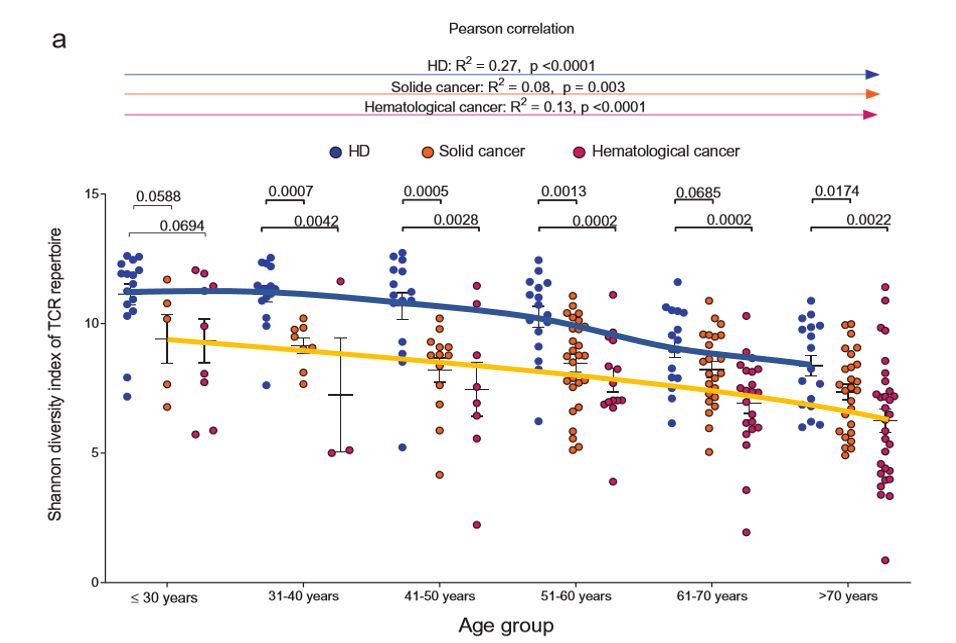
注:图中黄色线为患者 T 细胞多样性的下降趋势
化疗会损伤 T 细胞的多样性?
化疗是通过同时杀死癌细胞和正常细胞来治疗癌症的方法。化疗后,患者的身体非常虚弱,所以我们通常认为化疗也会损伤体内的 T 细胞,影响其功能。然而,在这项研究中,研究人员将癌症患者分为两组,年龄和疾病相似,一组不接受治疗,另一组接受化疗。结果显示,接受化疗的患者的 T 细胞多样性和克隆性没有显著变化。
总之,这些数据表明,人类 TCR 指标在老年人中逐渐恶化,但即使在老年癌症患者中,在 T 细胞耗竭治疗后,年龄特异性 TCR 指标也会恢复。
与年龄、疾病和治疗相关的 T 细胞免疫损伤在癌症患者中具有临床相关性,因为它决定了感染(尤其是病毒再激活和机会性感染)的易感性和抗肿瘤免疫控制的丧失。
衰老和癌症都会损害免疫细胞,而受损的免疫细胞反过来决定了免疫疗法的有效性。同时,免疫系统的衰老反过来会导致身体的衰老。
美国明尼苏达大学的研究人员及其合作者在《Nature》杂志上发表了一篇题为“An aged immune system drives senescence and ageing of solid organs”的文章,确定了免疫系统衰老对机体衰老的影响。

免疫系统的衰老或免疫衰老会导致老年人患病和死亡。他们选择性地删除了小鼠造血细胞中编码关键 DNA 修复蛋白的 Ercc1 基因,从而增加了内源性 DNA 损伤的负担,并导致免疫系统衰老。
结果表明:Vav iCre+/-;Ercc1−/fl 小鼠成年后是健康的,但表现出过早的免疫衰老,其特征是特定免疫细胞群的耗竭和衰老,以及免疫功能受损,类似于野生型小鼠衰老过程中发生的变化。
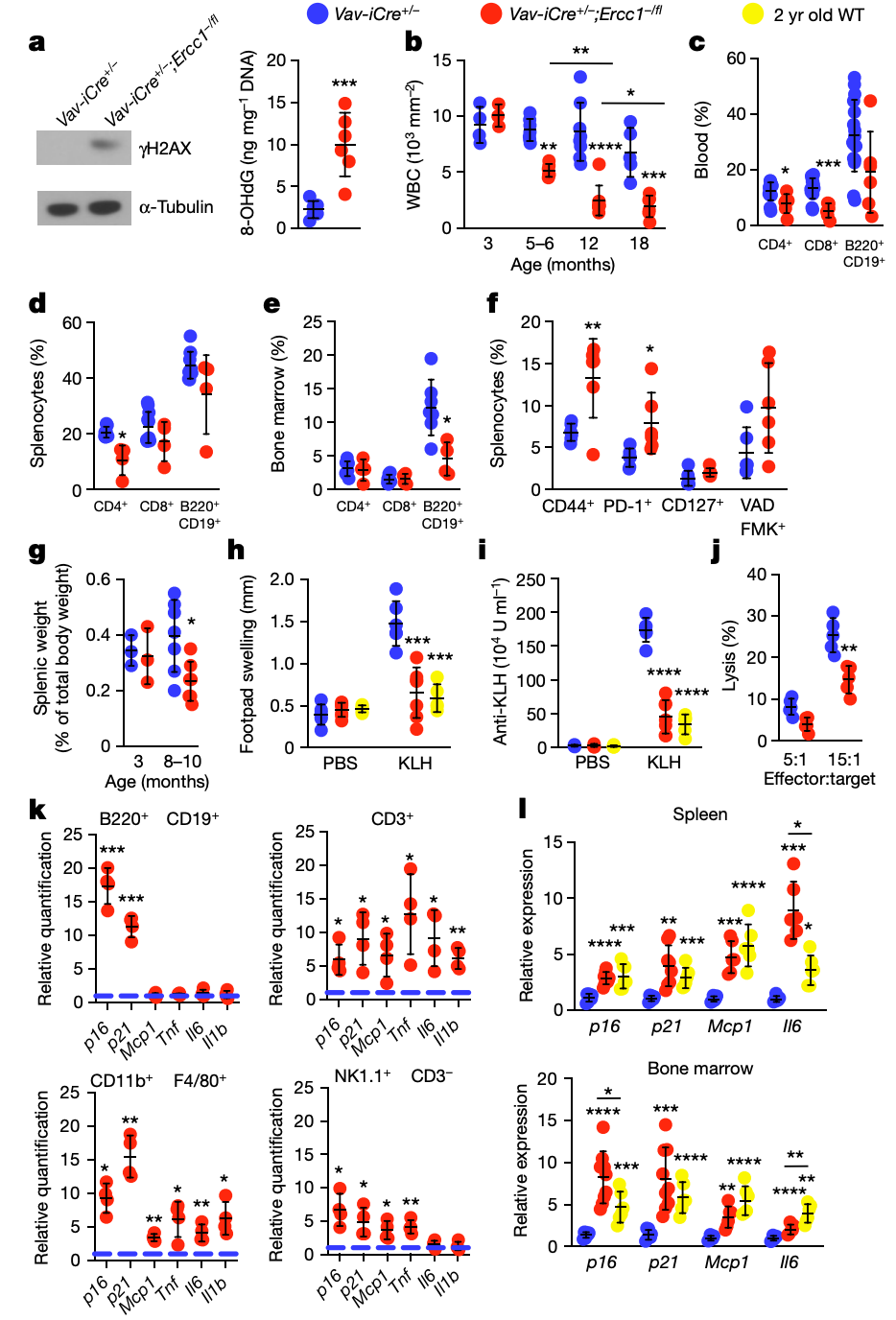
注:造血细胞中 Ercc1 的缺失会导致免疫系统加速老化
此外,他们还观察到衰老和非淋巴器官损伤的增加,表明衰老的免疫细胞可以促进全身衰老。将来自Vav-iCre+/-;Ercc1−/fl或老年野生型小鼠的脾细胞移植到年轻小鼠体内会反向诱导衰老,而年轻免疫细胞的移植会减弱衰老。
雷帕霉素治疗 Vav-iCre+/-;Ercc1−/fl 小鼠可以减少免疫细胞衰老标志物,改善免疫功能。这些数据表明,衰老的免疫系统在驱动系统衰老方面具有因果作用,使其成为延缓衰老的关键治疗靶点。
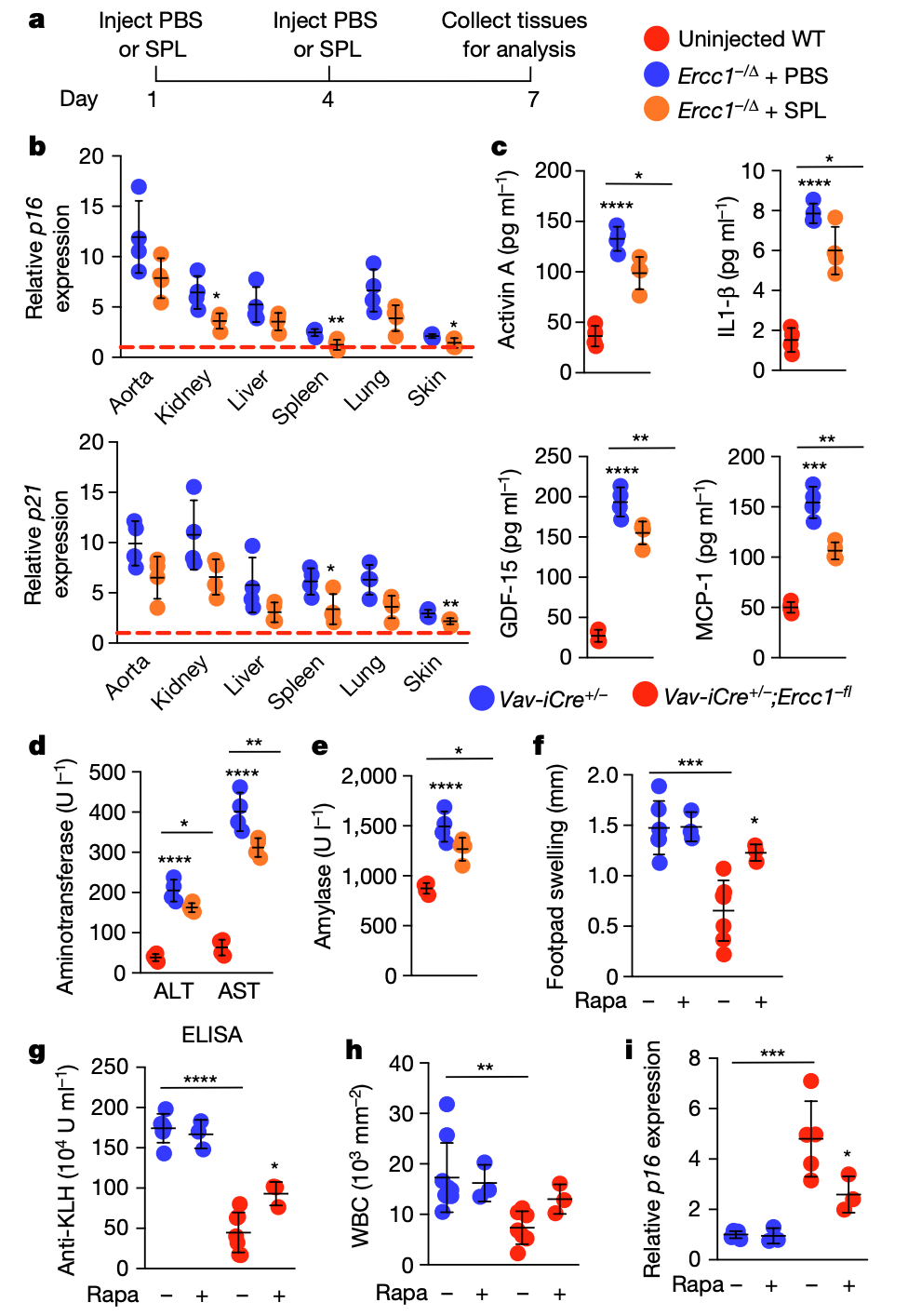
▲年轻小鼠的脾细胞移植可抑制老年受体的衰老和组织损伤,而雷帕霉素可改善 Vav-iCre+/-;Ercc1−/fl 小鼠的免疫功能
基于这些文献,我们可以看到癌症、衰老和免疫细胞是相互依赖和不可分割的。面对癌症和衰老这两大敌人,只有更好地了解我们的免疫细胞大军,明确免疫系统的运行机制,抓住疾病和健康状况的关键点,才能在治疗上取得事半功倍的效果。
免责声明:我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
