CAR-T疗法就是嵌合抗原受体T细胞免疫疗法,英文全称Chimeric Antigen Receptor T-Cell Immunotherapy。这是一种治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得很好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。
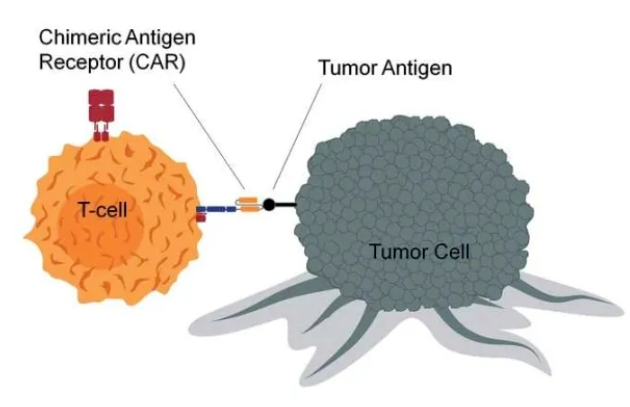
T细胞也叫T淋巴细胞,是人体白细胞的一种,来源于骨髓造血干细胞,在胸腺中成熟,然后移居到人体血液、淋巴和周围组织器官,发挥免疫功能。其作用相当于人体内的“战士”,能够抵御和消灭“敌人”如感染、肿瘤、外来异物等。
在实验室,技术人员通过基因工程技术,将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”,即CAR-T细胞,他利用其“定位导航装置”CAR,专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
在肿瘤免疫细胞治疗方面,CAR-T是国际上研究最为火热的肿瘤免疫治疗方法,其在白血病、淋巴瘤、多发性骨髓瘤的治疗中展现出惊艳的治疗效果,具有广阔的应用空间。在此基础上,我们一起来盘点一下CAR-T细胞治疗的最新研究进展。
一、新型免疫增强疗法或能增强CAR-T细胞疗法来治疗人类血液癌症
近期,华盛顿大学医学院和其他机构的科学家通过研究发现,在国际杂志Nature Communications上发表的一份题为“A long-acting interleukin-7, rhIL-7-hyFc, enhances CAR-T cells expansion, persistence and anti-tumor activity”的研究报告中,当注入这些转基因T细胞时,使用名为白介素7(IL-7)的免疫增强蛋白进行额外治疗可能会促进抗癌CAR-T细胞数量的增加,并更有效地杀死肿瘤细胞。

研究结果表明,研究人员或能利用IL-7来增强机体免疫系统的功能从而治疗疾病,包括将其与CAR-T细胞联合使用;此外,研究人员还研究了IL-7如何刺激T细胞来抵御败血症(一种针对感染的危及生命的反应),后期研究人员将有望利用长效的IL-7来增强T细胞治疗胶质母细胞瘤的效力。
二、科学家发现一种CAR-T细胞疗法治疗人类实体瘤的新型潜在靶点
近期,在国际杂志Molecular Cancer Therapeutics上发表的一篇题为“Olfactory Receptor OR2H1 is an effective target for CAR T cells in human epithelial tumors”的研究报告中,莫菲特癌症研究中心等机构的科学家通过研究确定了一个新的CAR-T细胞潜在靶点OR2H1,这可能有助于抑制肺癌和卵巢癌的生长。

目前,研究人员正在努力识别肿瘤生物标志物,以促进CAR-T细胞治疗更有效地治疗实体瘤。研究人员的目标是找到一种可以在肿瘤细胞中表达但在正常细胞中不表达的标记物,以减少潜在的不必要的副作用的发生。研究人员Jose Conejo Garcia说,我们重点研究了一种称为嗅觉受体的蛋白质家族,该家族在鼻腔中表达,促进嗅觉感知;在实验过程中,研究人员发现OR2H1蛋白也在多种实体瘤中表达,包括4%的结直肠癌样本到69%的胆囊癌样本。重要的是,在所有检查的正常组织中,仅在睾丸中发现OR2H1,这可能表明OR2H1的这种靶向治疗可能对正常细胞几乎没有影响。
随后,研究人员开发了对OR2H1蛋白具有特异性的CAR-T细胞。OR2H1 CAR-T细胞可以杀死表达OR2H1的肺癌和卵巢癌细胞,但对健康细胞没有影响。此外,OR2H1 CAR-T细胞在受到人类肿瘤攻击的免疫缺陷小鼠中也具有一定的抗肿瘤作用。在不同OR2H1水平的肺癌和卵巢癌小鼠模型中,研究人员观察到了某些肿瘤抑制作用,包括对化疗耐药的卵巢癌细胞。这些综合数据表明,OR2H1可能是实体瘤CAR-T细胞治疗的有效靶点,研究人员希望这些初步研究结果有望帮助开发用于各种实体瘤患者的OR2H1 CAR-T细胞。
研究结果表明,重新定向针对表达OR2H1的肿瘤细胞的T细胞或许代表了一种潜在的癌症疗法,其或有望治疗多种上皮性癌症,同时或许会产生一部分可接受的疗法所带来的毒性作用。
三、靶向EBAG9可增强对T细胞的抗癌症免疫反应
近日,Armin Rehm团队在Molecular Therapy期刊发表了题为“EBAG9-silencing exerts an immune checkpoint function without aggravating adverse effects ”的研究论文。

本研究进一步验证了以前的研究结果,证实了抑制EBAG9基因可以帮助CAR-T或TCR-T治疗更快更彻底地清除肿瘤细胞,这为CAR-T和TCR-T彻底治愈肿瘤带来了新的机遇。
四、合成的IL-9受体可让T细胞在不使用化疗或放疗的情形下在体内强劲杀死癌细胞
在一项新的研究中,由洛杉矶加利福尼亚大学的Anusha Kalbasi博士领导的一个研究团队与斯坦福大学和宾夕法尼亚大学的研究人员合作,发现了一种合成的IL-9受体,该受体使这些抗癌T细胞在无需化疗或放疗的情况下发挥作用。他们指出,斯坦福大学克里斯托弗·加西亚博士实验室设计的携带这种合成IL-9受体的T细胞对小鼠肿瘤具有很高的疗效。相关研究结果于2022年6月8日在线发表在Nature期刊上,论文标题为“Potentiating adoptive cell therapy using synthetic IL-9 receptors”。

Kalbasi说,“当T细胞通过这种合成的IL-9受体发送信号时,它们获得了新的功能:它们不仅可以帮助它们打败现有的免疫系统,还可以更有效地杀死癌细胞。在此之前,患者努力接受毒性化疗,只是为了破坏其现有的免疫系统,这样T细胞疗法就有机会进行斗争。但有了这项新技术,就可能会给予T细胞治疗,而没有必要提前破坏现有的免疫系统。”
五、病例研究表明TCR-T细胞有望治疗胰腺癌
在一项新的实验中,美国国家癌症研究所和普罗维登斯癌症研究所的研究人员增强了他们的免疫细胞的功能,并强调了未来治疗各种癌症的潜在新方法。Kathy Wilkes是一位患有晚期胰腺癌的女性,她发现自己的肿瘤急剧缩小。相关研究结果于2022年6月2日发表在NEJM期刊上,标题为“Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cance”。

他们从Kathy Wilkes的血液中提取T细胞,在实验室对其进行基因改造以表达这种TCR,然后在体外培养出数十亿表达这种TCR的T细胞,即TCR-T细胞。输注产生的TCR-T细胞六个月后,她的肿瘤缩小了72%。Kathy Wilkes说,最近的测试表明她的病情仍然稳定。
六、阻断TIGIT有望改善靶向CD19的CAR-T细胞疗法对非霍奇金淋巴瘤的疗效
在一项新的研究中,来自梅奥诊所、凯斯西储大学和克利夫兰医学中心的研究人员研究了以CD19为靶点的嵌合抗原受体T细胞治疗非霍奇金淋巴瘤患者缓解率下降的原因。相关研究结果于2022年5月12日在Cancer Discovery期刊上在线发表。本文标题为“Sequential single cell transcriptional and protein marker profiling reveals TIGIT as a marker of CD19 CAR-T cell dysfunction in patients with non-Hodgkin's lymphoma”。

Hwang博士说,最近的长期随访数据表明,非霍奇金淋巴瘤患者的CAR-T细胞治疗成功率可能正在下降。在这种情况下,持续缓解率在30%-40%之间。因此,识别预测性生物标记物来测量CAR-T细胞的耐药性至关重要,这样我们可以更好地为患者提供有效的治疗。
这些作者在CAR-T细胞注射到患者体内之前和注射到患者体内后的多个时间点生成了单细胞RNA和蛋白质测序数据。Hwang博士说,这项新研究产生了133000多个单细胞表达谱,他们利用这些数据开发并应用计算方法来分析与治疗反应相关的CAR-T细胞的单细胞水平RNA或蛋白质表达模式。
通过这些计算,作者发现一种称为TIGIT的基因在注射到对CAR-T细胞治疗无反应的患者体内的CAR-T细胞中高度表达。他们还证实TIGIT导致CAR-T细胞失效和功能障碍。他们发现用CAR-T细胞疗法阻断TIGIT可以提高体内研究的治疗效果。
七、开发出远程控制的CAR-T细胞,有望更安全更有效地治疗实体瘤
在一项针对小鼠的新研究中,斯坦福大学医学院的研究人员发现,一种癌症治疗方法,使用患者自己的转基因免疫细胞攻击癌细胞,如果可以通过口服药物打开或关闭,则更安全、更有效。相关研究结果于2022年5月12日发表在Cell期刊上,论文标题为“Enhanced safety and efficacy of protease-regulated CAR-T cell receptors”。

这些作者设计了一种称为SNIP CAR-T的转基因CAR-T细胞疗法,该疗法被美国食品和药物管理局(FDA)批准用于人类的抗肝炎口服药物激活。如果没有这种药物,SNIP CAR-T细胞就没有活性。
鉴于这种引发SNIP CAR-T细胞活性的口服药物已被FDA批准上市,这些作者希望在未来24个月内对实体瘤患者进行临床试验。
当这些作者在小鼠身上测试SNIP CAR-T细胞对抗实体癌的能力时,他们发现它们比传统的CAR-T细胞疗法更有效——在许多情况下,他们治愈了被称为髓母细胞瘤的脑癌或被称为骨肉瘤的骨癌小鼠。
令人惊讶的是,这些作者还发现,调整格佐匹韦的剂量使CAR-T细胞更具辨别力,其杀伤力集中在靶分子含量高的癌细胞上,而对靶分子含量低的正常组织没有影响。他们说,设计CAR-T细胞以识别也出现在健康细胞表面的靶分子的能力可能会改变治疗人类实体瘤的能力。
八、靶向CD123的CAR-T细胞特异性杀死白血病干细胞,有望阻止AML白血病复发
在一项新的临床前研究中,威尔·康奈尔医学院的研究人员发现,转基因免疫细胞(T细胞)成功地靶向可能导致急性髓系白血病(AML)复发的特定癌细胞,即白血病干细胞,并证实了该方法在急性髓系白血病动物模型中的有效性。这种新的细胞疗法目前正在进行一期临床试验,这可能最终帮助AML患者保持无癌状态。相关研究结果最近发表在《自然通讯》杂志上,论文标题为“Allogeneic TCRαβ deficient CAR T-cells targeting CD123 in acute myeloid leukemia”。

在这项新的研究中,作者让称为T细胞的免疫细胞产生嵌合抗原受体(CAR),使T细胞能够识别癌细胞表面的特定标记。就本研究而言,CAR与白血病干细胞表面的CD123分子结合,使表达这种CAR(CAR-T)的T细胞能够发现并攻击白血病干细胞。
当这些作者在急性髓系白血病小鼠模型中测试UCART123细胞时,他们发现该疗法有效地消除了白血病细胞并延长了生存期。他们还设计了一种超灵敏的监测策略来检测任何残留的癌细胞,并评估UCART123细胞的持久性。最后,他们证实UCART123细胞对白血病细胞具有特异性,对小鼠正常血细胞的毒性最小。
Roboz博士说:“这些临床前研究结果表明,UCART123细胞在靶向AML方面具有高度的选择性和特异性。我们希望古兹曼博士实验室开发的技术将帮助我们监测使用UCART123治疗的AML患者,并优化其成功率。”
九、经过四次碱基编辑的CAR-T细胞有望治疗复发或难治性的T-ALL白血病
在一项新的研究中,费城儿童医院的研究人员与Beam Therapeutics合作,开发并测试了一种使用碱基编辑的“现成”嵌合抗原受体(CAR)T细胞(CAR-T)疗法,旨在准确编辑与7CAR8对称的CAR-T细胞,并降低其他编辑方法可能带来不必要和不可预测结果的风险。
相关研究结果最近发表在Blood期刊上,论文标题为“Cytosine Base Editing EnablesQuadruple-Edited Allogeneic CAR-T Cells for T-ALL”。他们发现7CAR8在多种临床前模型中对T细胞急性淋巴细胞白血病(T-ALL)非常有效。T-ALL在复发的情况下通常对化疗无效,治愈的机会很低。如果获得批准,7CAR8有望成为这些患者的有效和挽救生命的治疗方法。

本文合著者、费城儿童医院儿童癌症研究中心主任医师兼临床研究主任David T.Teachey博士说,“实验室研究表明,7CAR8在临床前模型中具有很高的活性,如果获得批准,它可能成为复发性或难治性T-ALL儿童和成人的治疗药物。它也可能用于治疗其他CD7+恶性肿瘤,如T淋巴细胞淋巴瘤和急性髓系白血病亚群。基于这些结果,我们计划将7CAR8转化为复发性或难治性T-ALL儿童和成人复发性或难治性T-ALL临床治疗。这种高度自适应的基础编辑方法也可用于为其他免疫治疗靶点构建‘现成’的CAR。”
十、干扰素γ受体受体信号通路可让CAR-T细胞高效杀伤实体瘤
在一项新的研究中,麻省总医院(MGH)的研究人员发现干扰素γ受体(IFNgR)信号通路对胶质母细胞瘤对CAR-T细胞免疫治疗的易感性至关重要。在其他实体瘤中也观察到同样的现象。这一发现可以部分解释为什么液体肿瘤和实体肿瘤对CAR-T细胞治疗的反应非常不同。相关研究结果最近发表在Nature期刊上,论文标题为“CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours”。

为了确定实体瘤的耐药途径,在本文通讯作者兼麻省总医院癌症中心细胞免疫治疗项目主任Marcela Maus博士的领导下,这些作者对胶质母细胞瘤进行了全基因组CRISPR基因敲除筛查。
Maus博士说,展望未来,这一发现为科学家在临床实践中提供了两个机会。首先,通过靶向IFNgR信号通路来增强T细胞与肿瘤细胞结合的相互作用,CAR-T细胞治疗可能在实体瘤中产生更好的反应。其次,在液体肿瘤中阻断这一途径可能有助于减少众所周知的CAR-T细胞治疗的毒副作用,即细胞因子释放综合征。她补充说:“尽管CAR-T细胞疗法在某些情况下可以取得惊人的效果,并且某些液体肿瘤的治愈率超过40%,但其毒副作用是一个真正的问题。抑制干扰素在这些癌症中的作用可能会维持疗效,但会减少其毒副作用。”
十一、发现cBAF与c-Myc相互作用让T细胞变成记忆T细胞,有望利用CAR-T细胞治疗实体瘤
在一项新的临床前研究中,圣犹大儿童研究医院的研究人员发现了一种分子机制,为实体瘤的CAR-T细胞治疗开辟了前景。相关研究结果于2022年6月22日在线发表在Nature期刊上,标题为“cBAF complex components and MYC cooperate early in CD8+T cell fate”。

这些作者使用他们发现的分子信息来提高CAR-T细胞的功效。他们在CAR-T细胞激活过程中使用CBAF抑制剂,使其能够产生更多的记忆性T细胞。在临床前模型中,经这种cBAF抑制剂处理的CAR-T细胞比未经处理的CAR-T细胞更好地控制肿瘤生长。经这种cBAF抑制剂处理的CAR-T细胞也存活更长,数量更多。他们在多种实体瘤类型中重现了这一令人鼓舞的结果。这项新的研究首次表明,可以暂时修饰CAR-T细胞,以更有效地杀死实体瘤。
论文合著者、圣犹大儿童研究医院免疫科的Hongbo Chi博士说,“cBAF因子是促进CAR-T细胞在癌症治疗中作用的潜在靶点,但我们的研究也表明,通过更好地了解基本免疫生物学和T细胞功能,我们可以开发出更好治疗癌症和其他疾病的药物。”
免责声明:
我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
