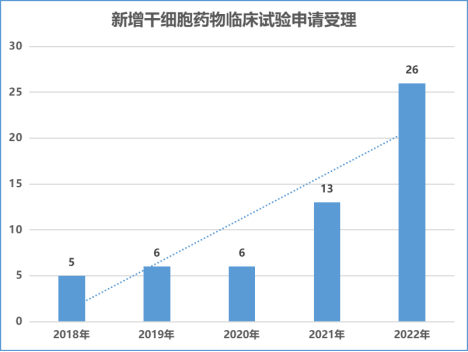
2018 年以来,国家药品监督管理局重新受理干细胞新药临床试验申请,干细胞药物临床试验申请数量稳步增长。从受理申请数量来看,申请数量从 2018 年的 5 个(以受理申请数量为基础)增加到 2022 年的 26 个,是 2021 的两倍,中国新型干细胞药物研发速度显著加快。
▲干细胞药品申报详情
01 干细胞药物临床试验申报情况
2022 年,CDE 共受理了 26 项干细胞药物临床申请(以受理数量为准),包括 25 项国内 1 类创新药物注册申请和 1 项进口 1 类创新药注册申请。
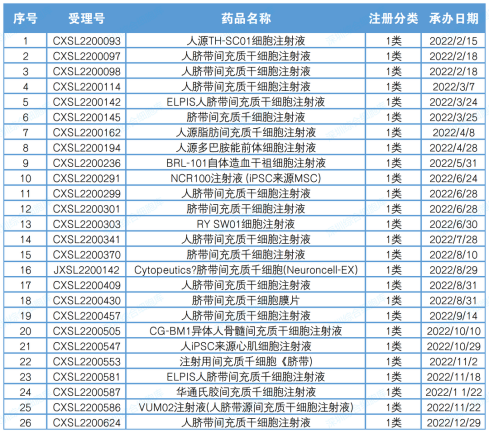
▲2022年度干细胞药物注册申报受理一览表
02 临床试验默示许可情况
2022 年,来自 11 家企业的 11 种干细胞药物的 16 项临床试验获得了 CDE 默示许可。其中,上海爱萨尔生物的人脐血间充质干细胞注射液已获批 2 项默示临床试验,泉生生物的人脐带血间充质造血干细胞注射液获批 4 项隐性临床实验。
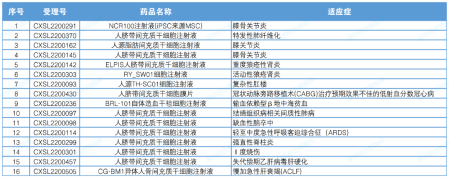
▲2022年度干细胞药物临床试验默示许可览表
03 临床试验适应证分析
截至 2022 年 12 月 31 日,CDE 已默认 42 项临床试验,涉及 20 个适应症。排名前三的是膝关节炎(七项)、间质性肺病(五项)和移植物抗宿主病(四项)。其中,6 家企业的 7 种干细胞药物用于治疗膝关节骨性关节炎。干细胞的类型包括:自体脂肪间充质干细胞(一种)、同种异体脂肪间充干细胞(两种)、脐带间充质细胞(三种)和 iPSC 衍生的间充质造血干细胞(一种)。
在适应症方面,大多数药物使用间充质干细胞的免疫调节功能来治疗炎症或自身免疫性疾病。
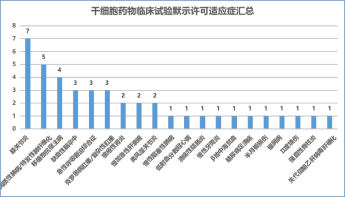
▲干细胞药品适应证详情
04 申报地区情况分析
在各省市的干细胞药物应用中,截至 2022 年 12 月 31 日,共受理 56 项申请,42 项临床试验申请获得隐性许可。
在申请受理方面,上海以 16 项排名第一,北京以 9 项排名第二,广东、江苏和天津紧随其后。在临床试验的默示许可方面,上海仍以 13 项排名第一,北京以 9 项排名第二,江苏、天津和广东紧随其后。可以看出,上海是干细胞药物研发最活跃的地区,而长三角、北京、天津和广东是中国干细胞药物研究和开发的主要地区。
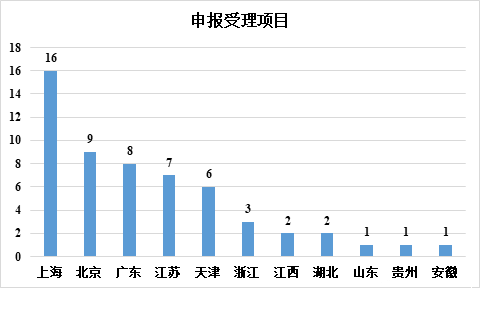
▲各省市干细胞药品申报受理情况
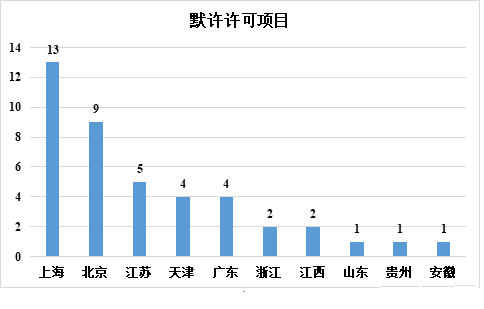
▲各省市干细胞药品临床试验默示许可情况
05 申报的干细胞类型分析
截至 2022 年 12 月 31 日,根据申报的干细胞类型,人类脐带间充质干细胞药物有 32 种,占 61.5%,是干细胞药物研发中最重要的细胞类型。特别是 2022 年,共受理 19 种脐带间充质干细胞药物,迎来大幅增长。其次,除了间充质干细胞,来自人类胚胎干细胞(ESC)和人类诱导多能干细胞(iPSC)的衍生细胞药物也在稳步增长。2022 年,添加了三种 iPSC 衍生的细胞药物。
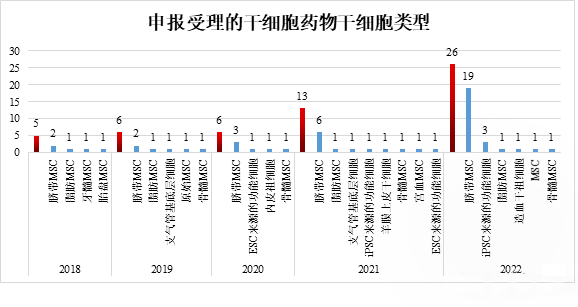
▲申报受理的干细胞药物干细胞类型情况
在基础研究领域,全球细胞治疗领域取得了许多重大原创成果。中国干细胞基础研究走在世界前列,为治疗许多疑难复杂疾病提供了新的希望。由于前期市场无序,我国干细胞的临床研究和临床试验一度停滞,导致干细胞产业上游储存业务相对成熟,中游开发和下游应用发展相对滞后。
随着《干细胞临床研究管理办法(试行)》《干细胞制剂质量控制和临床前研究指导原则(试行)和《细胞治疗产品研究与评价指导原则(试行)》等政策的出台,我国干细胞临床转化正逐步步入正轨,使用干细胞药物作为转化出口的路径逐渐清晰。随着政策的明确,经过一番探索,我国干细胞临床转化进入了有序发展阶段,干细胞药物的数量和质量都有了明显提高。
据信,2023 年将是干细胞药物研发的爆发期,更多具有新适应症的干细胞药物将进入临床试验阶段。与此同时,正在进行的干细胞药物的 I/II 期临床试验将逐渐产生结果。我相信,随着干细胞技术的不断发展,干细胞作为治疗药物将在不久的将来出现。
免责声明:
我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
