1995年,美国生物学家 Arnold Caplan 教授开启了全球第一例间充质干细胞的临床探索 。迄今为止,人类探索间充质干细胞临床应用的历史马上三十年。根据美国临床试验数据库 (Clinicaltrials.gov) 注册登记,间充质干细胞的临床试验几乎涵盖其可能应用的所有适应症。
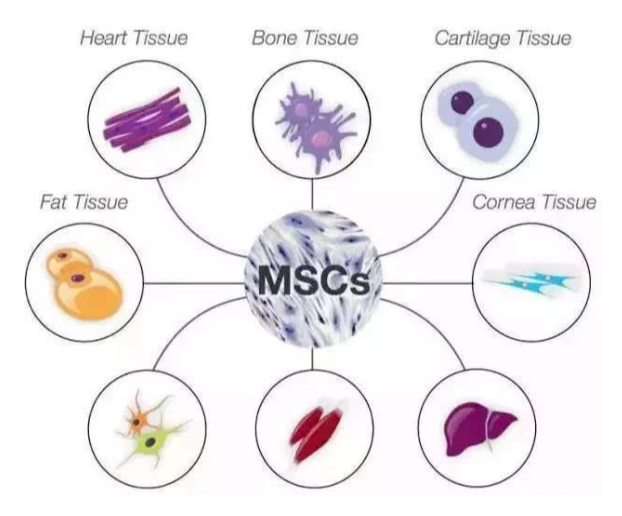
间充质干细胞(Mesenchymal Stem/Stromal cell,MSCs)被广泛用于命名各种组织来源的贴壁生长的成纤维细胞群,具有多向分化潜能、免疫调控及促进组织再生功能。目前来看,间充质干细胞已成为全球开展临床研究项目数最多的一种细胞。
国际上许多间充质干细胞药物已经进入 Phase III 阶段临床试验,用于治疗各种难治性疾病。随着欧洲、日本和印度相继批准了间充质干细胞药物上市,各大干细胞研发企业恢复了一定的信心。在已获批上市的28种细胞治疗产品中,包括21种干细胞产品,含10种造血干细胞产品、10种间充质干细胞产品和1种角膜缘干细胞产品。
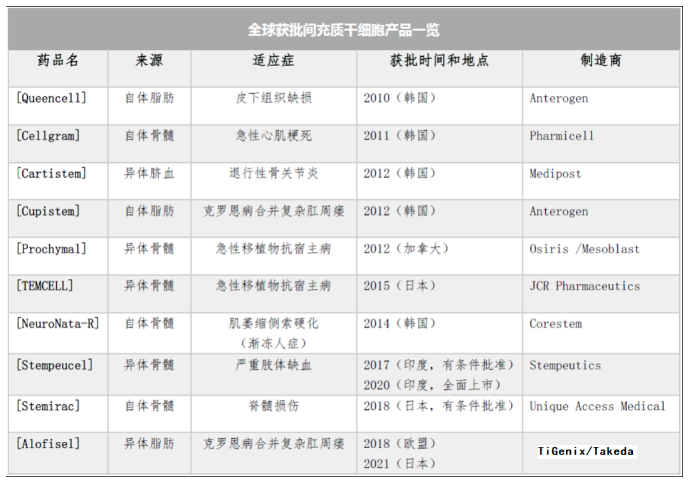
目前全球已获批有 10 种间充质干细胞产品,但迄今为止,美国 FDA 没有批准任何一款间充质干细胞产品上市。大部分已获批上市的间充质干细胞产品,根据其作用机制和批准的适应症可以分为两大类:组织修复和免疫调节,如移植物抗宿主病、膝骨关节炎、克罗恩病,严重肢体缺血等。

除上述产品,仍有一些临床中后期在研间充质干细胞药物。Mesoblast 公司已经完成 Phase III 阶段并申请 NDA,却遭 FDA 拒绝,理由是试验数据来自单臂试验而不是随机试验,建议至少在成人和/或儿童中进行一项随机对照试验,用以提关于治疗机制和疗效的补充信息。
在国内,干细胞治疗产品目前处在“类双轨制”的监管阶段。按照药品监管的称为临床试验,由企业通过注册 IND 并完成三期临床试验 ,最后是作为药品上市销售;按照医疗技术监管的称为临床研究,根据卫健委和药监局出台的《干细胞临床研究管理办法》,通过两委局的备案以后在单个中心开展研究者发起的干细胞临床研究,目前缺少转化应用的路径。目前,干细胞临床研究和转化按药品管理为主的趋势逐渐明朗。
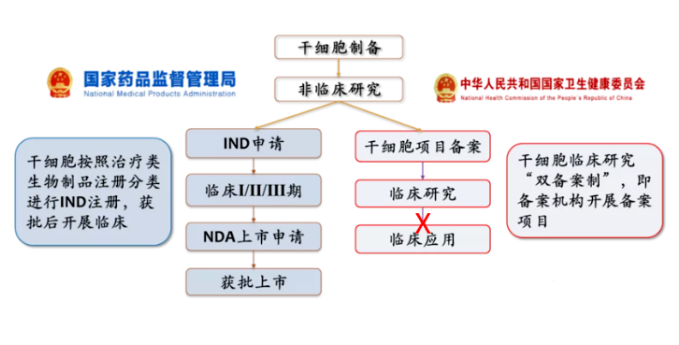
截至2022年5月,全国已有136家研究机构(含军队医院22家)在两委局或军委后勤保障部卫生局通过了干细胞临床研究机构的审核备案,共有111个干细胞临床研究项目(含多中心联合开展项目)通过审核备案。截至2022年7月,国家药品评审中心(CDE)也相继受理42项干细胞药物IND注册,目前通过默示许可获准进入临床试验的为29项。备案中明确使用间充质干细胞的有83 项,占比七成以上,注册临床实验中使用间充质干细胞的有21项,占比也达到了七成以上。
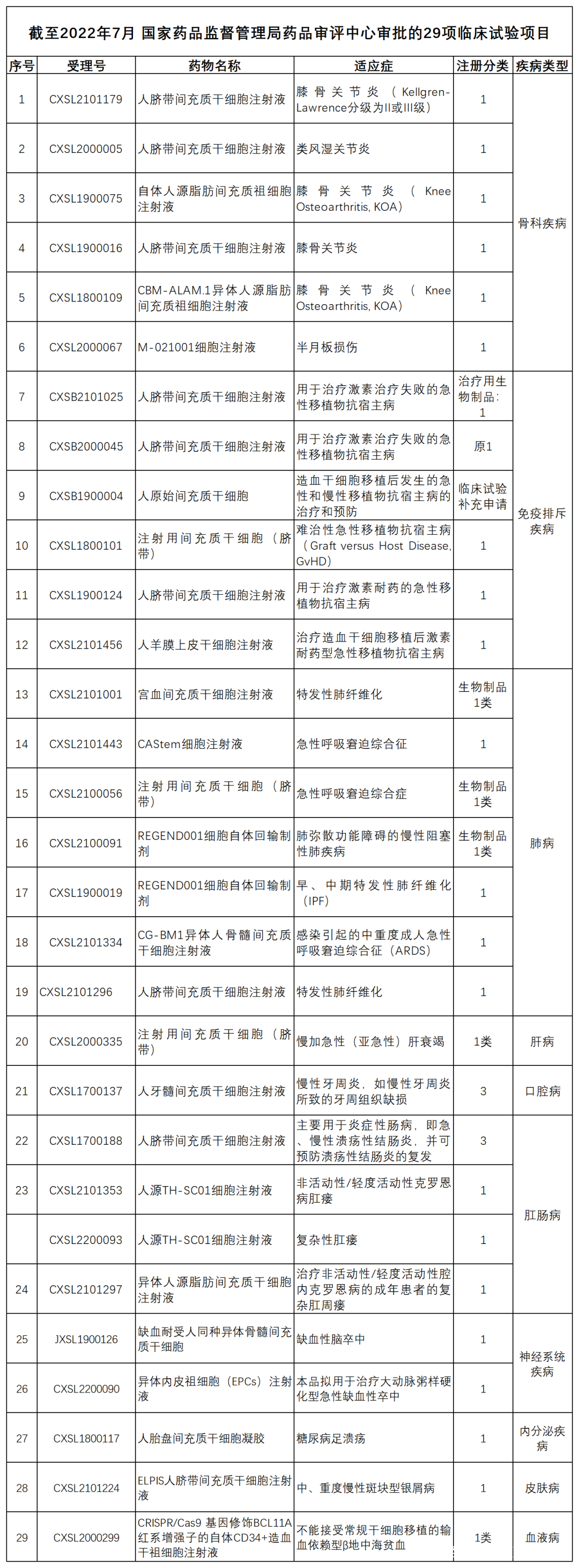
在过去30年里,第一波临床前和临床研究的巨大浪潮,将间充质干细胞疗法 (针对GVHD、克罗恩病和重度下肢缺血等三种适应症) 的商业化推上了历史的舞台。干细胞开始显示出巨大的临床治疗应用前景。

新冠疫情背景下,天岁生物与澳大利亚悉尼大学、哈佛大学、澳大利亚皇家威尔斯王子医院共同开展了“间充质干细胞治疗新冠病毒感染后肺纤维化”的科研合作,并取得一系列科研成果。
我国乃至全球的干细胞行业已逐渐形成了较为庞大的市场规模,新药不断上市,针对多系统疾病的临床试验也在持续开展当中。天岁生物将在细胞药物赛道不断加大各方投入,相信随着干细胞研究的深入以及市场的发展,在不久的将来,让广大患者用上安全、有效且实惠的细胞药物不再遥不可及。
免责声明: 我们尊重原创,也注重分享。部分图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
