在过去的 11 年里,在每年的 5 月,Emily 都会在社交平台发布了自己无癌生存的照片。今年,Emily Whitehead 基金会网站如期发布了 Emily 无癌生存 11 年的照片。

根据 Emily Whitehead 基金会网站的报道,“作为一个家庭,我们不再以癌症后的年份来标记时间。现在 Emily 已经成年,她已经准备好以更多的方式改变世界。我们要感谢大家的支持,感谢大家在过去的十一年里与我们分享这一刻!Emily 现在被认为已经痊愈,最近还庆祝了她的 18 岁生日。她期待着几周后高中毕业,今年秋天她将进入宾夕法尼亚州立大学(Penn State University)上大学。”
01 Emily 的抗癌故事
2010 年 5 月,5 岁的 Emily 被诊断患有急性淋巴性白血病。在经历了 16 个月的化疗之后,Emily 体内癌细胞死灰复燃,医生们束手无措了。
医生遗憾的通知艾米莉的父母,他们已经无能为力了,并建议将艾米莉带回家,让她在家人的陪伴下结束病痛的折磨。但是艾米莉的父母拒绝放弃治疗,他们开始四处寻找能够挽救艾米莉的方法,最终他们决定前往治疗儿童肿瘤最好的医院之一——费城儿童医院。

一切仿佛早有安排。就在他们去医院前一天,费城儿童医院刚刚获得批准,在儿童复发/难治性 ALL 患者中开展 CAR-T 疗法的临床实验,而这个小女孩仿佛注定被历史铭记。
CAR-T 疗法当时并没有在儿童肿瘤中进行过多的尝试,只在三名成人中进行了临床实验,其中两人得到了快速和完全的缓解。而对于艾米莉来说,会不会起效,会不会更糟,一切都是未知的。艾米莉的父母决定放手一搏,没有比即将失去心爱的女儿更糟的结果了。
2012 年 3 月 1 日,Emily 开始在费城儿童医院接受 CAR-T 治疗。
医生先在她的脖子上放置了单采导管;她的 T 细胞被提取并送到实验室进行生物工程改造和扩增。期间艾米莉被隔离接受了大剂量的化疗,等待接受全新的 CAR-T 疗法。
4 月初,艾米莉体内提取的那些被改造和扩增的 T 细胞,已经成为了既携带着识别肿瘤的“导航头”,又增强了杀伤肿瘤的“弹药库”的 CAR-T 细胞,被回输到已经奄奄一息的艾米莉体内,这些 CAR-T 细胞,一旦遇见表达对应抗原的肿瘤细胞,便会被激活并再扩增,发挥其极大的特异杀伤力,致肿瘤于死地。
大家都以为 Emily 会像火中的凤凰一样从灰烬中重生。但大部分人不知道的是,Emily 最初并没有像大家期待的那样涅槃重生,反而差点因为 CAR-T 疗法引起的最严重的副作用——细胞因子释放综合征(CRS)丧命!
艾米莉的血压下降到 53/29,体温上升到 105°F,她的身体肿胀得面目全非,呼吸困难,医生说她随时可能死去。就连 June 博士也说,Emily 活不过一夜,他希望 Emily 的父母停止所有 ICU 的干预,让 Emily 舒适的离去。June 博士认为这场免疫疗法革命因此结束,他甚至起草了相关的说明文件:“当试验中的第一位患者死亡时,是因为被称为细胞因子释放综合征的 5 级毒性。”所有的努力功亏一篑,一切也许要从零开始。
但幸运的是,大家都没有放弃最后一丝希望。在最后时刻,费城儿童医院收到了艾米丽体内细胞因子的测试结果,尽管 Emily 有许多细胞因子异常,但最引人注目的异常白细胞介素 6 (IL-6) ,医生们决定尝试托珠单抗,这也是最后的一丝希望。
值得一提的是,如今,托珠单抗是 CRS 的标准治疗方法,也是 FDA 批准用于治疗该并发症的唯一药物。艾米丽的康复对整个 CAR-T 治疗领域来说都是意义重大的,她作为实验者为这项成功的疗法踏平了前进的道路。
奇迹就这样出现了,艾米莉睡了一夜,给药后几小时内,Emily 的情况明显变好。第二天她就醒过来了,那一天正好是她的七岁生日。在接受治疗三周后,检测结果发现 Emily 的白血病病情有所缓解。之后的检查结果显示,她体内的癌细胞已经彻底消失了。她终于从死神手中挣脱了!
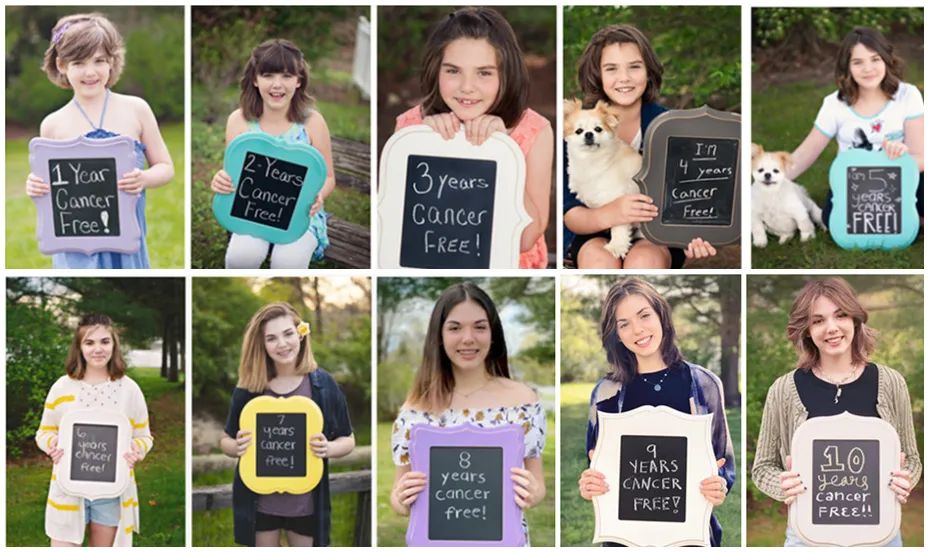
02 CAR-T免疫细胞疗法:癌症患者的新希望
细胞治疗因其高度精准化和个性化的优势,已成为未来人类医学发展的热门方向。自 2017 年首款 CAR-T 细胞疗法 Kymriah 获得美国 FDA 批准上市以来,已有 7 款 CAR-T 细胞疗法先后获得 FDA 批准上市。数据显示,CAR-T 细胞疗法在细胞疗法中占比最多,且显示逐年增长的趋势。其中,2022 年较 2021 年增长 24%。
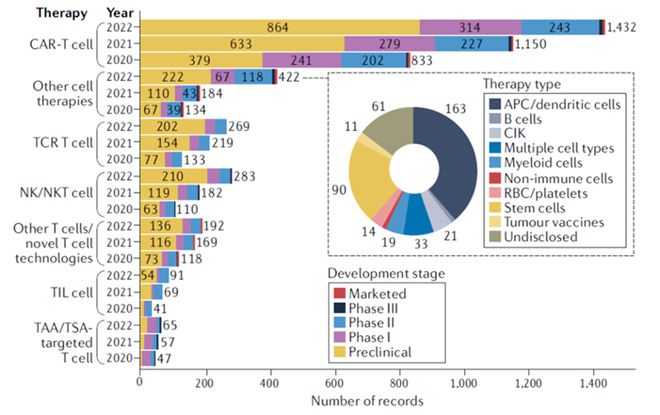
▲按疗法类型和年份划分的癌症细胞疗法管道的变化情况
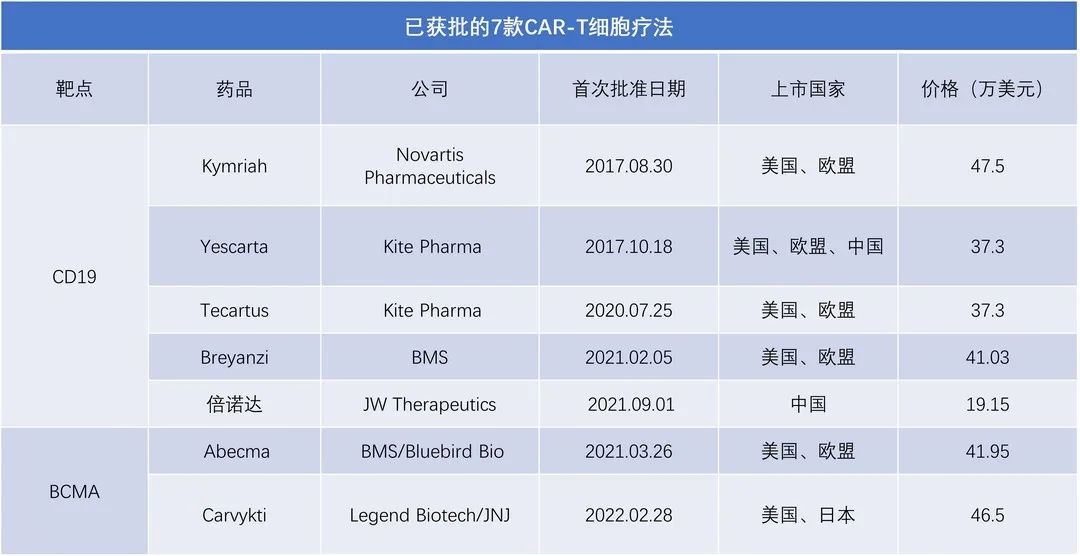
▲7 款 CAR-T 细胞疗法先后获得 FDA 批准上市
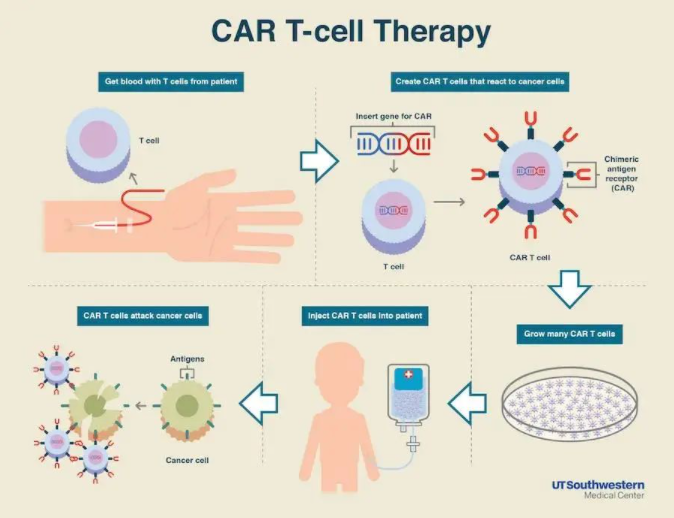
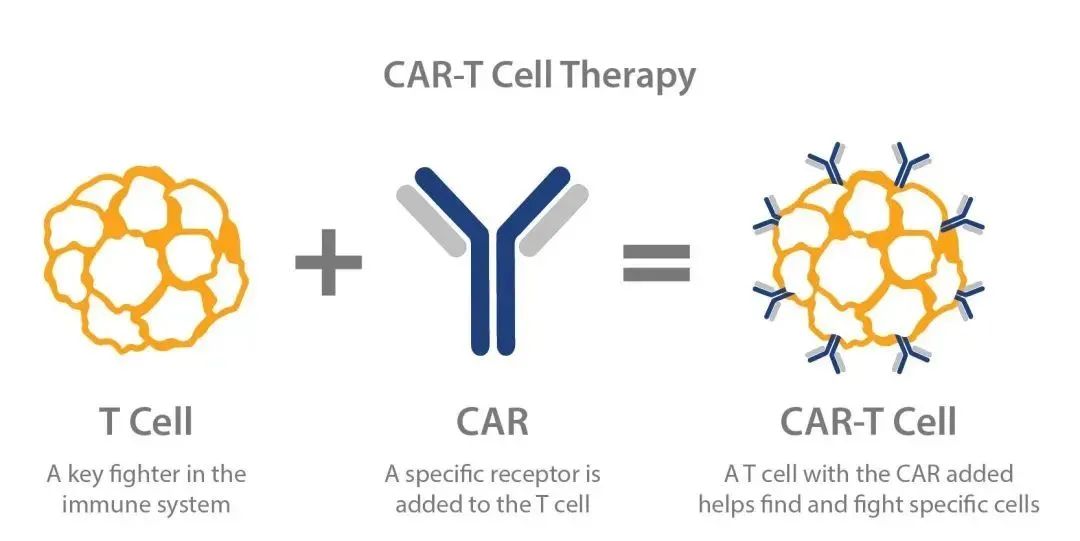
CAR-T 细胞实际上是利用基因工程技术添加嵌合抗体的工程 T 细胞。这些嵌合抗体可以识别肿瘤细胞并激活 T 细胞杀死它们,从而免疫从恶性肿瘤患者中分离的 T 细胞。在这一点上,T 细胞变成了 CAR-T 细胞。CAR-T 细胞可以检测体内的肿瘤细胞,激活身体的免疫功能,激活自身免疫,杀死肿瘤细胞。
目前,已经培养了 5 代 CAR-T 细胞,其中第 5 代 CAR-T 细胞与前几代相比,具有额外的细胞内结构域。因此,CAR-T 细胞分泌的信号不仅可以驱动 CAR-T 细胞保持活性并产生记忆 T 细胞,还可以重新激活和刺激免疫系统。
CAR-T 细胞治疗通常需要数周时间。CAR-T 细胞被重新引入患者的循环系统后,可以帮助捕获肿瘤细胞上的特定抗原,并在它们开始结合时将其摧毁,从而达到杀死肿瘤细胞的目的。
03 CAR-T 细胞治疗的未来挑战
CAR-T 细胞具有良好的治疗效果,但在临床试验中仍存在一些挑战,包括脱靶效应、细胞因子风暴、归巢、肿瘤微环境等问题。
● 毒副作用
CAR-T 细胞治疗的主要毒副作用是 CRS 和免疫效应细胞相关神经毒性综合征(ICANS),这是由 CAR-T 细胞的特性引起的。目前,可以减少其毒副作用的措施包括:通过改善 CAR-T 细胞的结构来减少细胞毒性,调整药物递送策略以减少剂量,以及通过常规药物治疗来减少毒副作用。
● 复发率
当 CAR-T 细胞治疗的疗效提高以满足大多数癌症患者的需求时,复发率水平成为另一个关键的评价标准。目前解决复发率问题的成熟策略是设计多靶点抗原 CAR-T 细胞,其中双靶点 CAR-T 细胞已在临床前研究中得到积极探索。
● 脱靶效应
CAR-T 细胞不仅可以杀死肿瘤细胞,还可以损伤人体内的正常细胞。肿瘤抗原分为肿瘤特异性抗原和肿瘤相关抗原。大多数肿瘤相关抗原对 CAR-T 具有亲和力,导致“脱靶”。因此,为了减少脱靶效应,有必要提高 CAR-T 细胞的杀伤特异性,选择肿瘤特异性抗原,开发只与肿瘤抗原相容的 CAR-T 细胞。
● 细胞因子风暴
细胞因子风暴是 CAR-T 细胞治疗中最常见、最致命的并发症之一,由 T 细胞、B 细胞、NK 细胞等释放大量炎性细胞因子引起。通过严格控制每次 CAR-T 细胞输入的数量和时间间隔,如 CAR-T 细胞输注过程中缓慢或分段输注,可以有效降低风险。研究发现,糖皮质激素和细胞因子拮抗剂可以降低因细胞因子风暴而死亡的风险。
● 归巢
CAR-T 细胞治疗实体瘤的疗效不佳是由于 T 细胞难以归巢到肿瘤部位以及肿瘤细胞抑制T细胞活性的能力(逃逸机制)。我们可以通过改变 CAR-T 细胞输注途径来改善归巢,例如将 CAR-T 细胞直接注射到实体瘤中,帮助 T 细胞到达肿瘤部位。
● 肿瘤微环境
实体瘤微环境富含免疫细胞、内皮细胞、细胞因子、细胞外基质分子和其他抑制CAR-T细胞活性的免疫抑制分子。克服肿瘤微环境中免疫抑制因子的干扰是实体瘤治疗中的一个主要问题。目前,CAR-T细胞治疗和化疗的结合可用于临床实践,对CAR-T细胞进行输血前清除/半清除方案。我们还可以通过联合放疗重塑或改善肿瘤局部免疫微环境,诱导新的免疫平衡状态。
近年来,CAR-T 细胞疗法在治疗血液系统恶性肿瘤方面显示出显著的疗效,在恶性肿瘤治疗领域引起了巨大的轰动,为我们治疗恶性肿瘤带来了新的希望。未来,通过理解和克服 CAR-T 细胞治疗面临的挑战,阐明导致局限性的机制,并克服这些障碍,预计 CAR-T 细胞可以更好地释放其潜力,改善患者预后。我们希望随着更多临床经验的积累和科学研究的探索,这种新的治疗方法能够更有效、更安全、更广泛地应用于患者,为医学发展和人类健康做出贡献。
免责声明: 我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
