当临床应用干细胞治疗时,选择哪个代次的干细胞治疗更加合适,是经常容易被问及的。这些都是应该思考和有待解决的问题。我们都是知道,人分男女老少,而干细胞也有年轻和衰老之分,因此,细胞的代数是影响干细胞活性及临床有效性、安全性的一个重要因素。
理论上讲,细胞代数越靠前,干细胞的干性也越强。但是干细胞在体外培养的过程中,干细胞有从组织微环境到体外培养环境的一个调整和适应过程,一部分不适应的细胞会被淘汰,所以在前两三代,干细胞基因组有着不稳定的因素,可能不宜临床应用。
有研究显示,通过核型分析发现,在前三代细胞中,干细胞存在异常核型的比例偏高。就如间充质干细胞(MSC)而言,临床应用的最佳代数应该在 4~6 代。
目前临床研究中,MSC 应用较为常见的来源骨髓、脂肪、脐带、胎盘等,本文以脐带、脂肪、胎盘这三类比较常见的来源进行总结,针对不同来源间充质干细胞,体外传代培养后不同代次的一些生物学特性的变化(例如:细胞形态、细胞周期检测、表面标记物检测、染色体核型分析、相关基因表达及细胞因子的定量分析),因可供参考资料有限,不足之处请谅解。
细胞传代
体外培养时,细胞在培养瓶中的生长过程主要分为 4 个阶段(如下图):
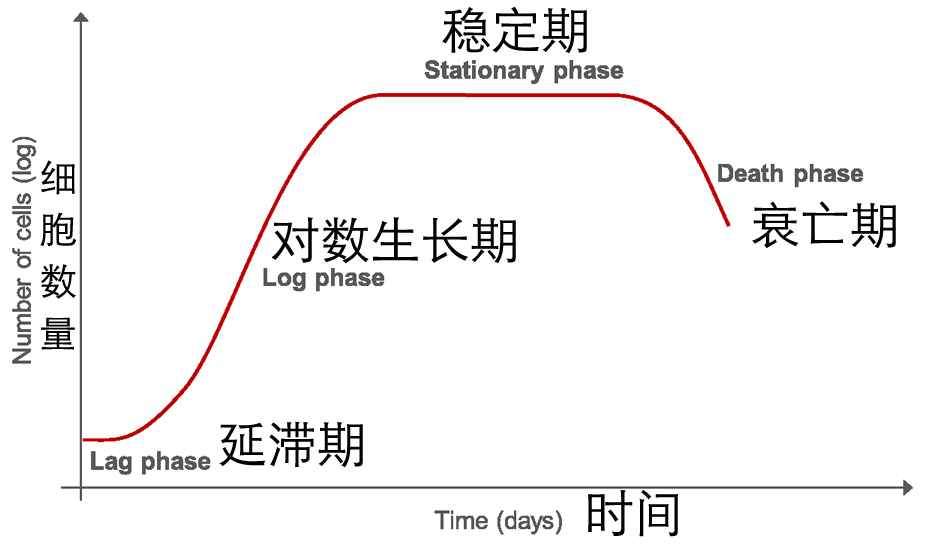
首先是延滞期,细胞接种到培养瓶后,起始的一段时间内是不增殖的,细胞数量保持不变。此阶段,细胞需要时间来适应新的培养环境;另外,进行细胞分裂之前,细胞内各成分(例如遗传物质)的复制与装配等也需要时间。
过了延滞期后,细胞开始分裂,进入对数生长期。此阶段,细胞数量急速增加。
细胞数量增加到一定程度时,细胞相互接触,产生接触抑制,细胞分裂生长速度减慢,直至完全停止生长,进入稳定期。
进入稳定期后,由于培养基中营养物质消耗,有害代谢产物积聚,细胞死亡数逐渐增加,进入衰亡期。
因此,为了避免大规模细胞死亡,细胞在进入稳定期时应及时消化,并重新接种到新的培养瓶中,这称为细胞传代。
从胎盘、脐带和脂肪其他组织中分离干细胞进行培养,称为原代培养,这一阶段的细胞为原代细胞(0 代)。原代细胞充满后,将细胞接种到新的培养瓶中,这是第 1 代。在第 1 代细胞长满后,将细胞接种到新的培养瓶中,这是第 2 代;第 2 代细胞充满后,将细胞接种到新的培养瓶中,即第 3 代细胞,依此类推。
胎盘间充质干细胞
足月胎盘是胎儿出生后的废物,易于获取,数量大,体积大,研究成本低,不涉及社会、伦理等问题。此外,胎盘间充质干细胞具有与骨髓间充质细胞相似的功能和特性,并且在增殖方面优于骨髓间充干细胞,可以大大增加间充质造血干细胞的数量。
一些研究分别测试了第 5、第 10 和第 15 代细胞的增殖能力。结果表明,第 5 代间充质干细胞的增殖能力显著高于第 10 和第 15 代细胞。实验结果表明,在体外培养胎盘间充质干细胞时,细胞会随着细胞代次的增加而逐渐老化。由于第 5 代后胎盘干间充质细胞的增殖能力会逐渐下降,因此最好选择第 5 代以下的间充质干细胞进行体外培养,作为临床应用。
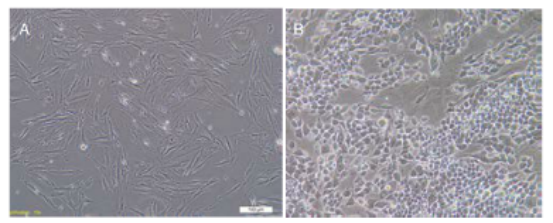
注:胎盘间充质干细胞镜下形态
图 A 为细胞贴壁后形态均一,呈长梭形,平行或漩涡状生长(×100);
图 B 为第 25 代细胞形态呈铺路石样改变(40×4)。
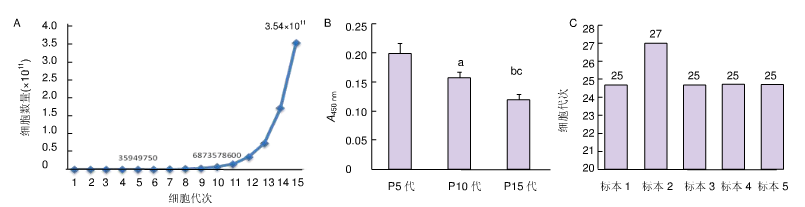
注:胎盘间充质干细胞生长曲线、增殖能力及传代结果
图 A 为第 5 代细胞的倍增时间明显短于第 10 代和第 15 代细胞的倍增时间;
图 B 为不同代次的胎盘间充质干细胞增殖能力不同,第 5 代增殖能力明显高于第 10 和第 15 代,与第 5 代比,aP<0.01,bP<0.001,与第 10 代比,c<0.05;
图 C 为胎盘间充质干细胞 5 例标本传至 25 代,无贴壁细胞或贴壁不牢,但增殖速度快。
在这项研究中,胎盘间充质干细胞可以长期传代培养到第 25 代。不同代次的胎盘间充质干细胞增殖能力不同,第 5 代的增殖能力显著高于第 10 代和第 15 代,这表明在临床应用前使用第 5 代是合适的。
脐带间充质干细胞
在各种来源的间充质干细胞中,人脐带源性间充质细胞(hUC-MSCs)作为一种更“年轻”的成人间充质造血干细胞,因其综合优势而受到越来越多的关注。
人脐带间充质干细胞的基本生物学特性,如细胞表面免疫标记物和诱导的多潜能分化潜能,在长期体外培养后没有显著变化。长期培养 20 代后,未发现致病或致瘤基因变异。高传代(P20)hUC-MSCs 与早期低传代(P5)hUC-MSCs 的细胞增殖活性和端粒酶活性无显著差异。随着培养传代次数的增加,细胞开始老化,尤其是第 20 代细胞。
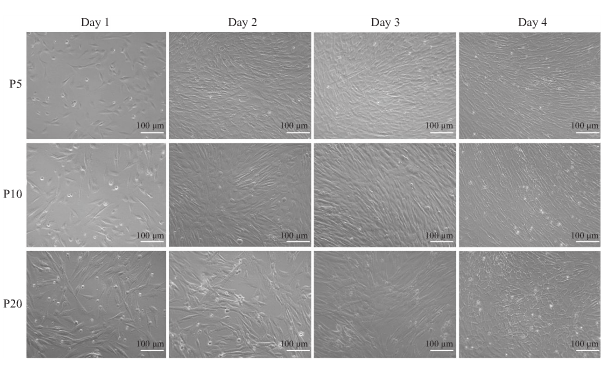
注:不同代次人脐带间充质干细胞的形态学观察
hUC-MSCs 在体外培养的第 5 代和第 10 代中显示出相同的细胞形态和生长模式,显示出长梭状贴壁生长和轻微螺旋流动排列。第 20 代细胞表现出非常相似的长梭形贴壁生长,但细胞体略有扩大,融合后局部排列紊乱。
已经表明,尽管在高传代培养中 hUC-MSCs 的核型保持稳定,但在第 7 代中端粒酶活性将下降。通过检测人端粒酶逆转录酶活性亚基基因的表达,我们发现第 5 代、第 10 代和第 20 代 hUC- MSCs 的端粒酶活性没有显著差异;不同世代的细胞表现出相似的生长和增殖曲线,表明它们的细胞增殖活性没有差异。
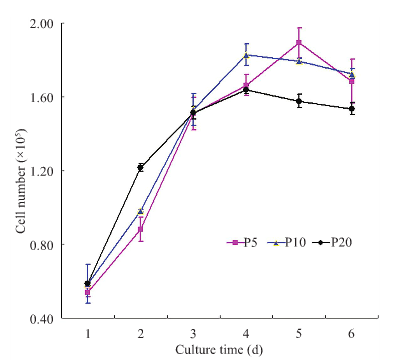
注:不同代次人脐带间充质干细胞的增殖活性检测
总之,尽管第 20 代 hUC-MSCs 仍然保持了与低代细胞相似的干细胞的生物学特性、基因稳定性和生长特性,但随着传代培养时间的延长,细胞开始显示出一定程度的老化。鉴于过度传代导致的 hUC-MSCs 老化迹象,建议用于临床干细胞治疗的 hUC-MSCs 体外培养不应超过第 10 代。
脂肪间充质干细胞
脂肪间充质干细胞(ADSCs)是脂肪组织中的多能干细胞。它的免疫原性很低,体外扩增相对容易。这些优点使其在组织工程、创伤修复和基因治疗中具有良好的应用前景。
在一些研究中,ADSCs 在体外培养至第 1、第 3、第 5、第 7、第 10、第 14 和第 15 代。结果发现,在 ADSCs 传代至第 7 代后,细胞的增殖速率开始减慢,并且在 10 代后细胞的增殖速度显著减慢。细胞呈长梭形,保持稳定。
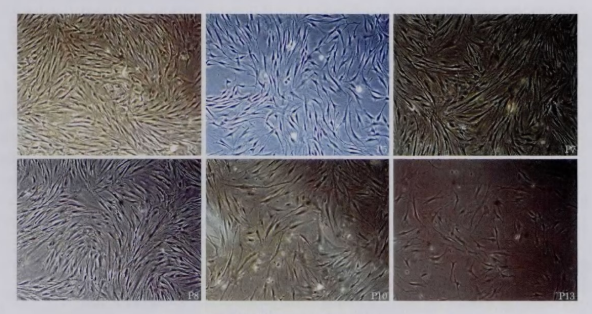
注:细胞形态观察
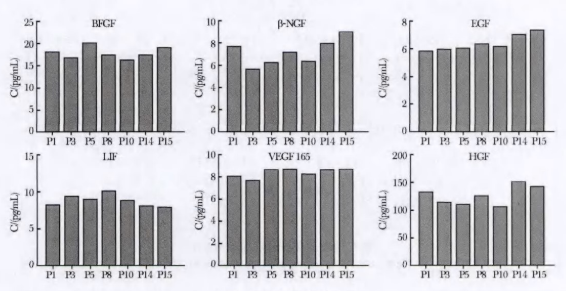
注:细胞因子定量分析
研究表明,脂肪来源的间充质干细胞(在无血清培养基中培养)的生物学和遗传特性基本稳定,在传代至第 5 代期间没有显著变化。初步揭示,脂肪来源的间充质干细胞在体外传代至第 5 代后可以安全使用。
从上述研究中不难看出,间充质干细胞在理论上可以长期传代培养,但在临床应用中不建议选择代次较高的干细胞。未在体外扩增的 MSCs 是安全无害的,除非它们有一些遗传缺陷,否则体外扩增的最大风险是基因突变。一个研究团队发现,当骨髓 MSC 在体外培养到第 18 代时,发生了基因突变和染色体异常。大量其他研究证实,只有当体外培养代数过高(超过 10 代)时,MSC 才会导致染色体异常。
影响干细胞回输安全性的另一个问题是添加剂,例如使用无血清培养基代替动物血清进行培养;通过严格的无菌操作避免使用抗生素。然而,对于细胞培养中不可替代的成分,如胰蛋白酶,在回输过程中严格检查质量以确保没有残留成分也是至关重要的。
免责声明:
我们尊重原创,也注重分享。图文来源网络,版权归原作者所有,如涉及作品内容、版权或其它问题,请联系我们删除!


 闽公网安备 35020602002648 号
闽公网安备 35020602002648 号 QQ 客服
QQ 客服
